|
|
||||
|
||||
|
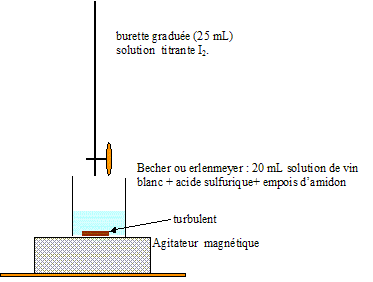
Pour éviter l'oxydation du vin, on ajoute du dioxyde de souffre au moût de raisin. La concentration massique en dioxyde de soufre est limitée à 210 mg.L-1 dans un vin blanc. On peut vérifier la concentration de dioxyde de soufre dans ce vin, en dosant SO2(aq) par une solution titrante de diode de concentration C=8,0 10-3 mol L-1. Dans un erlenmeyer, on verse un volume V=20,0 mL de vin blanc, 4 mL d'acide sulfurique afin d'acidifier ce milieu et 1 mL d'empois d'amidon. L'équivalence est obtenue après avoir versé un volume Veq=5,0 mL de solution de diiode. Schéma annoté du titrage : L'équivalence est repérée par le changement de couleur de la solution dans le becher : avant l'équivalence, le diiode est en défaut ( solution incolore ); après l'équivalence le diiode est en excès. En présence d'empois d'amidon le diiode donne une teinte violet foncé.
Equation de la réaction chimique support du dosage : SO2(aq)+2H2O =SO4²-(aq)+ 4H+ +2e- : oxydation de SO2. I2(aq)+2e- = 2I-(aq) : réduction diiode I2(aq) + SO2(aq) +2H2O(l) = 2I-(aq)+SO4²-(aq)+4H+ Quantité de matière de diode n(l2) versé à l'équivalence : volume (mL) * concentration (mol/L) = Véq C = 5 10-3 * 8 10-3 = 4 10-5 mol Quantité de matière de dioxyde de soufre dissoute dans la prise d'essai : à l'équivalence, d'après les coefficients stoéchiométriques de l'équation ci-dessus : n(I2)=n(SO2 )= 4 10-5 mol dans 20 mL de vin Concentration molaire en SO2 de ce vin : qté de matière (mol) / volume de la prise (L) =4 10-5 /20 10-3 = 2 10-3 mol/L Masse molaire SO2 : 32 + 2*16 = 64 g/mol. Concentration massique en SO2 du vin : 2 10-3 *64 =0,128 g/L = 128 mg/L, valeur inférieure à 210 mg/L. Ce vin est conforme. est il conforme ?
|
||||
|
|