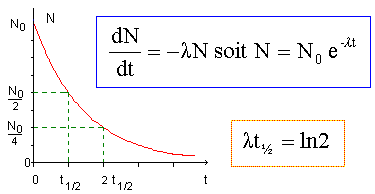|
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
Formule de l'acide éthanoïque CH3-COOH. Conductivité molaire ionique ( S m² mol-1) : l H3O+ =35 10-3 ; l CH3COo- =4,1 10-3 . Matériel : éprouvette graduée de 50 mL et 100 mL ; fioles jaugées de 50,0mL, 100,0 mL, 200,0 mL ; burette de 25,0 mL ; pipettes graduées de 5 mL et 10 mL ; pipettes jaugées de 5,0 mL ; 10,0 mL et 20,0 mL. La réaction entre l'acide éthanoïque et l'eau n'est pas totale. On se propose d'étudier l'influence de la dilution sur le taux d'avancement final de cette réaction et sur le quotient de réaction à l'équilibre Qr éq. On dispose au départ d'une solution aqueuse S1 d'acide éthanoïque de concentration c1 = 1,00 10-1 mol/L. A partir de cette solution on fabrique une solution S2 dix fois plus diluée que S1 et une solution S3 de concentration c3= 5,00 10-3 mol/L. Pour les mesures de conductivités on utilise le même volume V de chaque solution.
corrigé matériel nécessaire pour fabriquer S2 : le facteur de dilution est égal à F=10. de plus F= volume de la fiole jaugée / volume de la pipette jaugée = 10 d'où : fiole jaugée 50,0mL et pipette jaugée 5,0 mL; ou fiole jaugée 100,0mL et pipette jaugée 10,0 mL; ou fiole jaugée 200,0mL et pipette jaugée 20,0 mL. valeur de c2 = c1/10 = 1,00 10-2 mol/L. équation chimique de la réaction de l'acide éthanoïque avec l'eau : CH3COOH + H2O =CH3COO- + H3O+. avancement maximal : xmax pour une réaction totale, l'avancement maximal est égal à la quantité de matière (mol) du réactif limittant ; lorsque l'avancement maximal est atteint, la réaction s'arrête du fait du défaut d'un réactif.
conductivité s de la solution en fonction de la concentration en ion oxonium [H3O+]éq et des conductivités molaires ioniques des ions : s = l H3O+ [H3O+]éq + l CH3COo-[CH3COO-]éq la solution est électriquement neutre d'où : [H3O+]éq =[CH3COO-]éq par suite s =(l H3O+ + l CH3COo-) [H3O+]éq [H3O+]éq = s /(l H3O+ + l CH3COO-) = s /(35 10-3 + 4,1 10-3) = 1000s /39,1 mol m-3. l H3O+ =35 10-3 ; l CH3COo- =4,1 10-3 . taux d'avancement final de la réaction étudiée : t = xfin / xmax. xfin = [H3O+]éq V ; xmax = cV ; t =[H3O+]éq /c. quotient de réaction à l'équilibre Qr éq en fonction de [H3O+]éq et de la concentration en soluté apporté c : Qr éq = [H3O+]éq [CH3COO-]éq / [CH3COOH]éq = [H3O+]éq2 /[CH3COOH]éq conservation de l'élément carbone : [CH3COOH]éq + [CH3COO-]éq = c d'où [CH3COOH]éq = c-[CH3COO-]éq =c-[H3O+]éq par suite : Qr éq = [H3O+]éq2 /(c-[H3O+]éq) Influence de la dilution sur le taux d'avancement final de la réaction étudiée et sur la dissociation de l'acide dans l'eau : en ajoutant de l'eau ( dilution, on déplace l'équilibre dans le sens consommation de l'eau ( donc dans le sens direct); il se forme davantage d' ions H3O+ L'acide est plus dissocié ; le taux d'avancement final se rapproche de 1. influence de la dilution sur le
quotient de réaction à l'équilibre Qr éq : |
||||||||||||||||||||||
|
|