|
d'après concours technicien laboratoire 97 ( chimie ) |
||||||||||||||||||||
|
||||||||||||||||||||
|
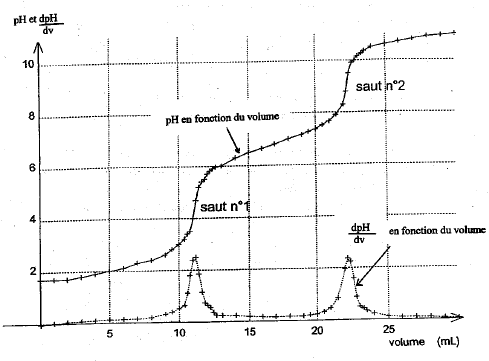
Concentration de la solution d'hydroxyde de sodium cB= 1,25 10-1 mol/L.
corrigé 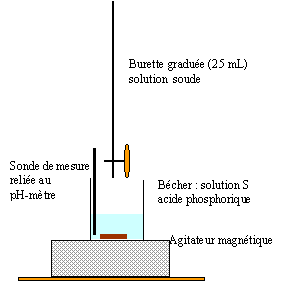
Les 10 mL de la prise sont prélevés à la pipette jaugée + pipeteur
saut 1 : H3PO4 + HO- = H2PO4- + H2O saut 2 : H2PO4- + HO- = HPO42- + H2O au premier saut de pH: Vequi = 24,3 / 2 = 12,15 mL Vs [acide phosphorique]= Vequi[soude] soit [acide phosphorique] = 12,15*0,125/10 = 0,152 mol/L masse molaire H3PO4 : M = 3+31+64 = 98g/mol ; 0,152*98 = 14,9 g/L. On peut réaliser un dosage colorimétrique avant de réaliser le dosage pHmétrique. La zone de virage de l'indicateur coloré doit contenir la valeur du pH au point équivalent . pour repérer le premier saut (pH voisin de 4) : vert de bromocrésol , hélianthine pour repérer le second saut (pH voisin de 9) : phénolphaléine
|
||||||||||||||||||||
|
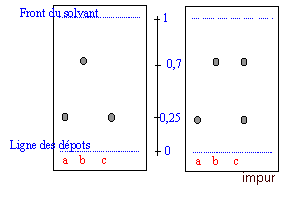
On a préparé de l'acide benzoïque à partir d'alcool benzylique. On suspecte l'acide benzoïque obtenu de contenir de l'alcool benzilique, même après une première purification. Pour lever le doute on réalise une CCM. Le révélateur est la lumière UV.
corrigé La chromatographie permet de séparer et d'identifier les constituants d'un mélange. Elle est basée sur la différence de solubilité d'un produit dans le solvant (l'éluant) et dans le support fixe solide. Le révélateur ( KMnO4, vapeurs de diiode) réagit chimiquement avec des produits incolores fixés sur le support et les rend visibles ou encore l'action de la lumière UV sur les composées aromatiques. Préparation de la cuve : Verser l'éluant jusqu'à 1cm de hauteur environ au fond d'un grand bécher. Couvrir. Préparation de la plaque : Tracer au crayon à papier une ligne à un peu plus de 1cm du bas de la plaque . Marquer au crayon sur cette ligne (ligne des dépôts ) les emplacements où l'on déposera les solutions à aalyser. Les emplacements doivent être distants d'environ 1cm, et à au moins 1cm des bords. Dépôt de l'échantillon A l'aide d'une pipette pasteur, ou d'un tube capillaire, déposer une goutte sur la plaque à l'emplacement marqué. Laisser sécher . Si la solution est trop diluée, on peut faire plusieurs dépôts au même emplacement , à condition de bien sécher la plaque entre deux gouttes. Développement du chromatogramme : Lorsque les dépôts sont secs, placer la plaque le plus verticalement possible dans la cuve, ligne de dépôt vers le bas. La surface de l'éluant doit être en de cette ligne. Couvrir. Surveiller la plaque régulièrement : quand l'éluant est à environ 1cm du bord supérieur, sortir la plaque, marquer le niveau atteint par le solvant au crayon à papier, sécher la plaque. L'acide benzoïque et l'alcool benzylique possédant un noyau benzénique peuvent absorbés les rayons UV. Sur la plaque CCM sensible aux UV on observera donc des taches sombres ( en éclairant avec une lampe UV) aux endroits des taches.
a : acide benzoïque pur ( étalon) ; b : alcool benzylique pur ( étalon) ; c : produit à analyser. (on observe deux taches dans lesquelles on identifie l'acide benzoïque et l'alcool benzylique en comparant les rapports frontaux avec ceux des substances étalons)
|
||||||||||||||||||||
|
L'élément fer est présent sous forme d'ions Fe2+ et Fe3+. On transforme les ions fer II de l'échantillon de vin blanc en ion fer III puis on complexe l'ensemble des ions fer III par les ions thyoscianate. La concentration du complexe coloré est déterminée par spectrophotométrie. Le mode opératoire est le suivant :
corrigé 2Fe2+ =2 Fe3+ + 2e- : oxydation des ion fer II ( le réducteur Fe2+ cède des électrons) H2O2 + 2H+ + 2e- = 2H2O 2Fe2+ + H2O2 + 2H+ = 2 Fe3+ +2H2O La solution du complexe est rouge brune et absorbe au maximum sa couleur complémentaire ( lumière de longueur d'onde l= 480 nm) Le tableau indique que l'absorbance et la concentration sont proportionnelles : A= k c avec k = 0,12 / 2 = 0,06 L mg-1. concentration totale en élément fer du vin étudié : 0,54 / 0,06 = 9 mg/L.
|
||||||||||||||||||||
|
|