|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
I- Réalisation de la pile : On réalise une pile à partir des couples Pb2+(aq) / Pb(s) et Sn2+(aq)/Sn(s). Les ions Pb2+(aq) proviennent d'une solution de nitrate de plomb( Pb2+(aq)+2NO3-(aq)), les ions Sn2+(aq) proviennent d'une solution de nitrate d'étain ( Sn2+(aq) +2NO3-(aq)). La demi-pile de gauche contient le métal étain plongeant dans une solution de volume V2 = 30,0 mL, C2= 2,0 10-2 mol/L. La demi-pile de droite contient le métal plomb plongeant dans une solution de volume V1= 20 mL, C1 = 3,0 10-2 mol/L. Le pont salin est réalisé avec du nitrate de potassium. M(Pb)= 207,2 ; M(Sn)=118,7 g/mol ; e = 1,6 10-19 C ; NA= 6,02 1023 mol-1 ; Pb2+(aq) + Sn(s) = Sn2+(aq)+ Pb(s). K1= 2,18 Sn2+(aq)+ Pb(s) = Pb2+(aq) + Sn(s) ; K2 = 0,46. L'électrode positive de cette pile est l'électrode de plomb.
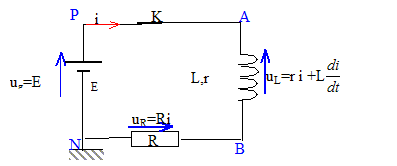
II. Circuit RL : on remplace la pile maison par un générateur de tension stabilisée de fem E=1,5 V. Le montage électrique consiste en une association série d'une bobine réelle (L ; r= 8,6 W), d'un conducteur ohmique (R=10 W ), d'un interrupteur et du générateur.
corrigé 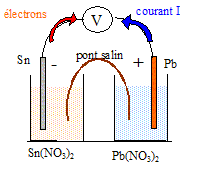
Sn (s ) = Sn2+(aq)+ 2e- : oxydation du réducteur l'étain. Pb2+(aq) +2e-=Pb (s ) réduction de l'oxydant Pb2+(aq) Sn (s ) + Pb2+(aq) = Sn2+(aq) + Pb (s ) Dans la solution et dans le pont salin, les cations positifs se déplacent dans le sens conventionnel du courant, tandis que les anions négatifs se déplacent en sens contraire. utilité du pont salin : assure la continuité électrique et assure l'électroneutralité des solutions. variation de masse de l'électrode de plomb : augmentation de masse Q=It= 0,015*2*3600 = 108 C soit n(e-) = 108/96500 = 1,12 10-3 mol d'électrons. or Pb2+(aq) +2e-=Pb (s ) d'où n(Pb)= ½n(e-) =5,6 10-4 mol masse de plomb correspondante (g) = n(Pb) M( Pb) = 5,6 10-4
*207,2 = 1,16 10-1 g ( 0,12 g)
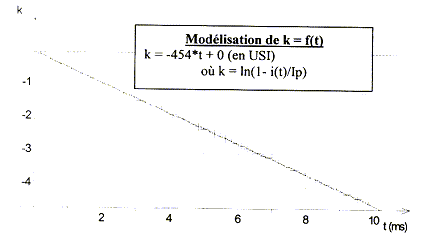
valeur de la constante de temps : d'une part i=IP(1-exp(-t/t)) soit i/IP = 1-exp(-t/t) d'autre part k = ln(1-i/IP) = ln(exp(-t/t)) = -t/t = -454 t d'où t = 1/454 = 2,20 10-3 s. valeur de l'inductance de la bobine :t = L/(R+r) soit L= t (R+r) = 2,20 10-3 *18,6 = 4,1 10-2 H. la constante de temps est homogène à un temps exprimé en seconde : t = L/(R+r) ½LI² a la dimension d'une énergie en J ; L a la dimension d'uné énergie divisée par une intensité au carré : J A-2. (R+r) I² t a la dimension d'une énergie soit (R+r) a la dimension d'uné énergie divisée par une intensité au carré, divisée par un temps : J A-2 s-1. donc L/(R+r) a la dimension d'un temps. équation différentielle traduisant l'évolution temporelle du courant i(t) : ug = uL+uR ; E= ri+Ldi/dt+Ri Ldi/dt + (R+r)i = E soit di/dt = E/L-(R+r)/L i = E/L-454 i= 36,59-454 i compléter le tableau : i(10-3) =i(5 10-4) + Di(tn) = i(5 10-4) + (di/dt)5 10-4Dt = 0,018+28,29*5 10-4 = 0,0321 A (di/dt) 10-3=36,59-454 *0,0321=21,99. i(1,5 10-3) =i(1 10-3) + Di(tn) = i(1 10-3) + (di/dt) 10-3Dt = 0,0321+21,99*5 10-4 = 0,0431 A (di/dt) 1,5 10-3=36,59-454 *0,0431=17,02. i(2 10-3) =i(1,5 10-3) + Di(tn) = i(1,5 10-3) + (di/dt) 1,5 10-3Dt = 0,0431+17,02*5 10-4 = 0,0516 A (di/dt) 1,5 10-3=36,59-454 *0,0516=13,16.
avec un pas plus petit on augmente la précision, mais on multiplie le nombre de calculs.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
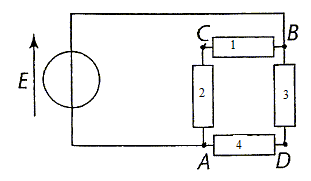
Les quatre conducteurs ohmiques sont identiques R= 10 W; E= 6,0 V
corrigé résistance équivalente entre les points A et B du circuit : 1 et 2 en série, équivalents à 2R ; de même pour 3 et 4, équivalents à 2R puis 2 résistors de valeur 2R en dérivation : d'où la résistance équivalent à l'ensemble Réqui =2R*2R/(4R) = R. intensité du courant traversant le générateur : I= E/Réqui = 6/10 = 0,60 A. puissance du transfert par effet joule pour l'ensemble des conducteurs ohmiques : Réqui I²= 10*0,6² = 3,6 W chaque résistor est traversé par une intensité de valeur 0,3 A : la puissance consommée par chaque résistor est RI² = 10*0,3² = 0,9 W d'où le choix 1W. le conducteur ohmique de résistance R trouvée précédemment ne peut être utilisé seul entre les bornes A et B du circuit, car la puissance consommée par ce dernier est 3,6 W, bien supérieure à la puissance maximale tolérée 1W.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
corrigé acide éthanoïque CH3-COOH ; (CH3)2CH-CH2-CH2OH : 3-méthylbutan-1-ol CH3-COOH + (CH3)2CH-CH2-CH2OH = CH3-COO-CH2-CH2-CH(CH3)2 + H2O lente, athermique, limitée par l'hydrolyse de l'ester. volume d'acide et d'alcool qu'il faut utiliser : masse (g) = Qté de matière (mol) * masse molaire (g/mol) ; puis diviser la masse (g) par la masse volumique (g/mL) acide : 0,2*60 / 1,05 = 11,4 mL ; alcool : 0,2*88/0,8 = 22 mL quantité d'acide restant dans le milieu réactionnel : vBcB=0,035*2 = 0,070 mol rendement de cette transformation : il s'est formé 0,2-0,07 = 0,13 mol d'ester rendement 100*0,13/0,2 = 65%. masse d'ester (g) = Qté de matière (mol) d'ester * masse molaire ester (g/mol) = 0,13*130 = 16,9 g. obtention d'un rendement supérieur au précédent : en ajoutant l'acide en excès pour 0,2 mol d'alcool ( réactif limitant), on déplace l'équilibre vers la droite, consommation de l'acide, fabrication d'ester ( loi de Le Chatelier) . La quantité d'ester augmente alors que la quantité initial de réactif limitant ne change pas : donc le rendement augmente. constante d'équilibre K associée à l'équation de la réaction : K=[ester]éq[eau]éq/([alcool]éq[acide]éq) K= 0,13*0,13/(0,07*0,07) = 3,45. rendement de cette seconde préparation : on note x l'avancement à l'équilibre. K= X²/((1-X)(0,2-X))= 3,45 X² = 3,45(1-X(0,2-X) = 3,45X²-4,14 X+0,69 2,45X²-4,14 X+0,69= 0 la résolution donne X= 0,187 mol rendement : 0,187*100/0,2 = 93,7 %.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|