|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On considère la pile - Cu(s)/Cu2+(aq) //Ag+(aq)/Ag(s) + L'électrode de cuivre plonge dans un becher contenant 50 mL d'une solution de nitrate de cuivre II de concentration c1 = 0,10 mol/L. L'électrode d'argent plonge dans un becher contenant 50 mL d'une solution de nitrate d'argent I de concentration c2 = 0,10 mol/L. Un pont électrolytique contenant du nitrate de potassium permet le contact électrique entre les deux solutions aqueuses.
corrigé 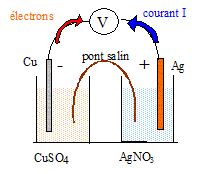
anode négative : Cu(s) = Cu2+(aq) + 2e- cathode positive : Ag+(aq) + e-= Ag(s) Quantité d'électricité : Q= I t = 0,1 * 60*16 = 96 C quantité de matière d'électrons (mol) : n(e-) = Q/(NA e) =96/(6,02 1023 *1,6 10-19 ) = 9,97 10-4 mol n(Ag) = n(Ag+) =n(e-) = 9,97 10-4 mol masse d'argent apparue : m(g) = n(Ag) M(Ag) = 9,97 10-4*108 = 0,107 g. n(Ag+) initial = c1*volume (L) = 0,1*0,05 = 5 10-3 mol n(Ag+) final = n(Ag+) initial -9,97 10-4 = 4 10-3 mol dans 0,05 L ; [Ag+]fin = 4 10-3/0,05 = 0,08 mol/L. n(Cu) = n(Cu2+) =½ n(e-) = 4,98 10-4 mol masse de cuivre disparue : m(g) = n(Cu) M(Cu) = 4,98 10-4*63,5 = 3,16 10-2 g. n(Cu2+) initial = c2*volume (L) = 0,1*0,05 = 5 10-3 mol n(Cu2+) final = n(Cu2+) initial +4,98 10-4 = 5,5 10-3 mol dans 0,05 L ; [Cu2+]fin = 5,5 10-3/0,05 = 0,11 mol/L.
Cu(s) + +2 Ag+(aq) = Cu2+(aq) +2Ag(s) ; K= [Cu2+(aq)]éq / [Ag+(aq)]éq2 = 4,6 1015. [Ag+(aq)]éq2 = [Cu2+(aq)]éq/K avec [Cu2+(aq)]éq = 7,5 10-3 /0,1 = 7,5 10-2 mol/L [Ag+(aq)]éq2 =7,5 10-2 / 4,6 1015 = 1,6 10-17 ; [Ag+(aq)]éq = 4 10-9 mol/L
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
H : 1 ; C : 12 ; O : 16 g/mol corrigé formules semi-développées et les noms des isomères acides carboxyliques et esters de formule brute C3H6O2 : CH3-CH2-COOH acide propanoïque ; CH3-COOCH3 éthanoate de méthyle ; HCOOCH2-CH3 méthanoate d'éthyle expression de la constante d'acidité du couple acido- basique CnH2n+1COOH / CnH2n+1COO-: Ka = [CnH2n+1COO-][H3O+] / [CnH2n+1COOH] équation chimique de la réaction entre l'acide CnH2n+1COOH et les ions HO-: CnH2n+1COOH + HO- = CnH2n+1COO- + H2O
Or cAVA-cBVE = 0 ; cAVA/cB = VE d'où Ka = y / [VE-V] ; y = Ka [VE-V] .
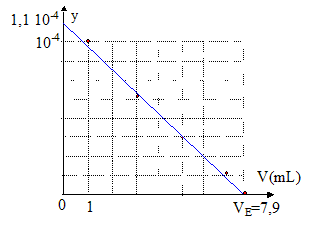
L'ordonnée à l'origine donne 1,1 10-4 = Ka VE d'où Ka = 1,1 10-4 /7,9 = 1,4 10-5 soit pKa = 4,85. cA= cBVE /VA= 0,05*7,9/20 = 0,02 mol/L 0,02 = m/M soit M= 1,34 / 0,02 = 74 g/mol M= 12n + 2n+1+45 = 74 d'où n=2. CH3-CH2-COOH acide propanoïque
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|