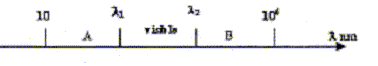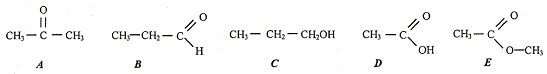|
|
||||
|
||||
|
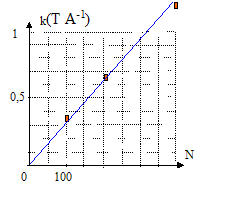
Pour différentes intensités I du courant dans trois solénoïdes de même longueur L, les mesures du champ magnétique B ( mT) au centre de ces derniers ont permis de tracer les graphes suivants : 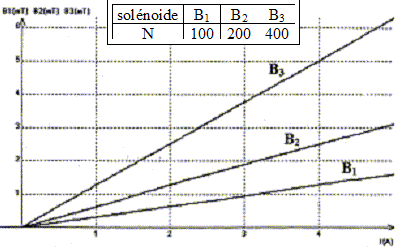
corrigé Les trois graphes sont des droites passant par l'origine : le champ et l'intensité du courant sont proportionnelles soit B= k I avec k, constante de proportionnalité. k1 = 10-3 / 3 = 3,33 10-4 T A-1 ; k2 = 2,5 10-3 / 4 = 6,25 10-4 T A-1 ; k3 = 5 10-3 / 4 = 12,5 10-4 T A-1 ; coube représentative de k en fonction de N, nombre de spires du solénoïde ( k a été multiplié par 103 sur le graphe)
k et N sont proportionnels ; de plus B= kI d'où B= k'NI ( k' = constante) le champ B et la longueur du solénoïde L sont inversement proportionnels : quand l'un double, l'autre est divisé par 2. B= k'NI / L convient car :
|
||||
corrigé domaine A : infrarouge (IR) ; domaine B : ultraviolet (UV) longueurs d'ondes l1 : 800 nm et l 2 = 400 nm une onde de fréquence n= 640 1012 Hz se déplace dans le vide à la célérité de la lumière c = 3 108 m/s. domaine auquel appartient cette onde : l = c/n =3 108 /640 1012 =4,7 10-7 m = 470 nm, valeur comprise entrel1 et l 2, donc domaine "visible". vitesse de l'onde dans le milieu d'indice n=1,5 : c/n=3 108/1,5 =2 108 m/s. La fréquence de l'onde caractérise l'onde : elle reste constante quel que soit le milieu traversé par l'onde. l = c/n : n étant constant, la célérité c dépend du milieu , donc la longueur d'onde dépend du milieu traversé ; dans ce milieu d'indice n la longueur d'onde diminue et vaut l 0/n, l 0 longueur d'onde dans le vide. La lumière "laser" est une source de lumière monochromatique. |
||||
|
Données : césium 55Cs ; xénon 54Xe ; baryum 56 Ba ; iode 53I. En 1986, lors de la catastrphe de Tchernobyl, l'explosion d'un réacteur nucléaire a provoqué la libération, dans l'atmosphère, de césium 134 et 137.
corrigé point commun entre le césium 134 et le césium 137 : isotopes, ils ont le même nombre de protons, mais des nombres de neutrons différents. composition d'un noyau de césium 137 : 55 protons ; 137-55 = 82 neutrons. équation de la désintégration de ce noyau : 13755Cs = AZX+0-1e ( électron) conservation de la charge : 55=Z-1 soit Z= 56 ( élément baryum 56Ba) conservation du nombre de nucléons : 137 =A+0 Le rayonnement g appartient aux ondes électromagnétiques. définition du temps de demi-vie t½ : durée au bout de laquelle la moitié des noyaux initiaux se sont désintégrés. Or A= l N avec l constante radioactive et N nombre de noyaux présents à la date t. à t=0 : A0 =l N0 ; à t½ : Nt½=½N0 d'où At½ = l½N0 = ½A0.
|
||||
|
Lors de la fabrication de spécialités homéopathiques on effectue des dilutions successives à partir d'une solution de base ( la teinture mère TM). La première dilution ou première centésimale Hahnemanienne ( 1 CH) consiste à ajouter 99 gouttes de sovlant à une goutte de teinture mère et à agiter vigoureusement. La seconde dilution consiste à ajouter 99 gouttes de sovlant à une goutte de solution 1CH et à agiter vigoureusement, on obtient la solution 2CH et ainsi de suite.
corrigé facteur de dilution quand on passe de la teinture mère à la solution 1 CH. F1= volume solution fille 1CH / volume solution mère = nombre total de gouttes / nombre de goutte issue de la solution mère = 102. F2 =F1*F1 = 104 ; F3 = 106 c1 = c/F1 = 1/102 = 1,0 10-2 mol/L ; c2 = 1,0 10-4 mol/L ; c3 = 1,0 10-6 mol/L ; c12 = 1,0 10-24 mol/L nombre de molécules de principe actif dans 1 L de solution 12 CH : c12 NA= 1,0 10-24 * 6 1023 = 0,6.
|
||||
corrigé 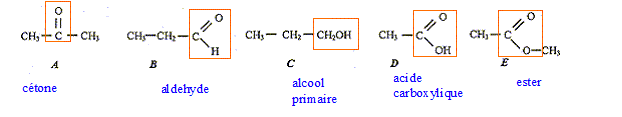
isomères : même formule brute, mais des formules développées différentes. A et B ( C3H6O) Les composées C et D sont des liquides, leur mélange subit une transformation : estérification. composition initiale du mélange : mC=150*0,8 = 120 g ; n(C) = mC/M(C) = 120/60 = 2 mol mD=120*1 = 120 g ; n(D) = mD/M(D) = 120/60 = 2 mol Si la transformation était totale, on devrait obtenit 2 mol de F. Or on obtient seulement 4/3 mol de F, donc la transformation est limitée. composition du mélange final : C et D : 2-4/3 = 2/ 3 mol ; F : 4/3 mol ; eau : 4/3 mol
|
||||
|
Lorsqu'on verse de l'acide chlorhydrique dans une solution de thiosulfate de sodium on observe la lente apparition d'un précipité blanc jaunatre de soufre. Cette transformation est modélisée par la réaction d'équation : S2O32- aq + 2H+ = S (s) + SO2(g) + H2O (l)
corrigé S2O32- aq +6H++ 4e- = 2 S(s) + 3H2O réduction ; S2O32- joue le rôle d'oxydant du couple S2O32- aq/ S(s) S2O32- aq + H2O = 2SO2(g) + 4e- +2H+ oxydation ; S2O32- joue le rôle de réducteur du couple SO2(g)/S2O32- aq ajouter ces deux demi-équations : 2S2O32- aq +4H+ = 2 S(s) + 2H2O+ 2SO2(g) les ions thiosulfates jouent un double rôle, oxydant et réducteur d'où le nom "dismutation" donné à cette équation.
|
||||
|
|