|
|
||||
|
||||
corrigé Masse molaire : M= 55,85*2+3*96+18n = 399,7 +18n. la proportion en fer représente 111,7 g et correspond à 22,8% d'où M= 111,7/0,228 = 489,9 g/mol soit 399,7 +18n = 489,9 ; n=5. Qté de matière d'ion fer III (mol)= volume (L) * concentration (mol/L) = 0,25*0,15 = 3,75 10-2 mol Or Fe2(SO4)3= 2Fe3+ + 3SO42- d'où n(Fe2(SO4)3, 5H2O)= ½ 3,75 10-2 = 1,875 10-2 mol masse à peser : 1,875 10-2 * 489,9 = 9,18 g.
|
||||
|
Soit un mélange d'acide éthanoïque CH3COOH de concentration c0 et d'éthanoate de sodium CH3COO- Na+ de concentration c'0.
conservation de l'élément carbone : [CH3COOH] +[CH3COO-]=c0+ c'0 (1) [CH3COOH](1+ [CH3COO-] / [CH3COOH])=[CH3COOH](1+Ka /[H3O+]) = c0+ c'0 (4) (1) -(2) donne : [CH3COOH]= c0+[HO-]-[H3O+](5) (4) et (5) donnent : ( c0+[HO-]-[H3O+]) (1+Ka /[H3O+]) = c0+ c'0 effectuer : c0Ka /[H3O+]+[HO-]-[H3O+] -Ka +Ka[HO-] /[H3O+]=c'0 Ka /[H3O+](c0+[HO-]-[H3O+]=c'0 +[H3O+] -[HO-] [H3O+]= Ka ( c0-[H3O+] +[HO-]) / ( c'0+[H3O+] -[HO-]) si [H3O+] et [HO-] sont négligeables devant c0 et c'0 : [H3O+]=Ka c0 / (c'0. si en plus des confitions précédentes c0=c'0 : [H3O+]=Ka. à1 L du mélange précédemment mentionné avec c0=c'0 = 1 mol/L. On y ajoute 0,1 mol d'acide fort. Calcul du pH final. 0,1 mol d'ion acétate disparaît et il se forme 0,1 mol d'acide acétique d'où : [CH3COOH]f=1,1 mol ; [CH3COO-]f=0,9 mol. [H3O+] = Ka[CH3COOH]f/[CH3COO-]f= 1,58 10-5*1,1/0,9 =1,93 10-5 ; pH= -log2,17 10-5 =4,71 variation du pH si on ajoute 0,1 mol d'acide à 1 L d'eau pure : pHf= -log 0,1) = 1 ; DpH= -6
|
||||
|
3Fe2+ = 3Fe3+ +3 e-. NO3- + 4H+ +3 e- = NO+2H2O NO3- + 4H+
+3Fe2+ = 3Fe3+ + NO+2H2O
(1) 6Fe2+ = 6Fe3+ +6 e-. Cr2O72-+ 14H+ +6 e- = 2Cr3++7H2O Cr2O72-+ 14H+ +6Fe2+ = 6Fe3+ +2Cr3++7H2O (2) concentration C2 des ions Fe2+ de la solution ainsi préparée : M( sel de Mohr) = 391,85 g/mol n(Fe2+) = m/M= 7,845 /391,85 = 0,02 mol dans 0,1 L soit C2 = 0,2 mol/L. masse d'azote (m) contenue dans la solution préparée : n(Cr2O72-) = V3C3 d'où n(Fe2+) excès = 6 V3C3 d'après les coefficients de (2) n(Fe2+) total =V2C2 ; n(Fe2+) réagit =V2C2- 6 V3C3 ; n(NO3-) = 1/3 n(Fe2+) réagit d'après les coefficients de (1) masse d'azote : n(NO3-) *14 = 14 / 3 (V2C2- 6 V3C3 ) =4,67 (V2C2- 6 V3C3 ) m(azote) = 4,67 (10*0,2- 6 *7,4*0,01 )10-3=7,26 10-3 g dans 10 mL de la solution d'engrais soit 7,26 10-2 dans 100 mL ou dans 1,25 g d'engrais ou 7,26/1,25 = 5,8 %.
|
||||
corrigé formule brute correspondante : CnH2n+1Br ; M= 12n+2n+1+80 = 14 n +81 = 137 soit n= 4 formule brute de A : C4H8. CH3-CH2-CH=CH2 but-1-ène ; CH3H>C=C<HCH3 (Z) but-2-ène ; CH3H>C=C<HCH3 (E) but-2-ène ; ceux-ci conduisent à : CH3-CH2-CHBr -CH3 2-bromobutane et à CH3-CH2-CH2 -CH2Br 1-bromobutane (CH3)2C=CH2
2-méthylpropène ; il conduit à (CH3)2CH-CH2Br
1-bromo-2-méthylpropène et à (CH3)2CBr-CH3et
à 2-bromo-2-méthylpropène
A : méthylbenzène ou toluène ( réaction Friedel et Crafts) le groupe méthyle du cycle oriente en ortho et para lors d'une seconde substitution électrophile sur le noyau benzénique : B et B' : o -nitrotoluène et p-nitrotoluène.
|
||||
|
|
||||
|
|
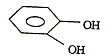 phénol
; orthodiphénol
; cyclohexane1,2-diol ; paradiphénol.
phénol
; orthodiphénol
; cyclohexane1,2-diol ; paradiphénol.