|
d'après
concours technicien
chimiste Lille 2004
|
|
|
|
|
Problème
1.

- Affecter la lettre correspondante à chacun des
risques donnés dans la liste suivante : 1 corrosif (F) ; 2 : comburant (H) ; 3 inflammable (A) ; 4 nocif ou irritant (C) ; 5 radiations ionisantes
ou radioactif (G) ;
radiations non ionisantes (D)
; risque laser (B) ;
toxique (E).
Problème 2
- 1 picogramme est égal à 10-6g
; 10-9g ; 10-3mg ; 10-9mg. 10-9 mg = 10-9
*10-3 g = 10-12 g
- Quel est le point
commun de tous les éléments suivants : 32P ; 35S
; 14C ; 3H. éléments radioactifs instables.
- A 25°C et à la
pression atmosphérique, HCl pur est : un gaz
; un liquide ; un solide.
- A 25°C et à la
pression atmosphérique, NaOH pure est : un gaz ; un liquide ; un solide.
- L'air est
constitué d'un mélange.
- Indiquer les deux gaz les plus abondants dans le mélange. N2 et O2.
- Indiquer pour chacun d'eux leur pourcentage approximatif : N2 (80%) et O2 (20%).
- Que signifient les
abréviations des polymères suivants : PE ( polyéthylène) ; PP (
polypropylène) ; PVC ( polychlorure de vinyle ) ; PS (
polystyrène).
- Si on verse de
l'eau sur le sodium, que se passe-t-il ? réaction violente avec dégagement
d'hydrogène et projection de soude.
- Ecrire la réaction chimique correspondante : Na + H2O = NaOH + ½H2.
- Est-ce le procédé normal de détruire les restes de sodium ? (non)
Sinon comment procéder ? stockage
dans un récipient à l'abri de l'humidité, de l'eau en
vue récupération ; réaction evec l'éthanol absolu.
- Parmi les couples
de solvants suivants, indiquer ceux qui ne sont pas miscibles :
eau-acétonitrile ; eau méthanol ; eau-
chloroforme ; hexane -eau.
|
|
Problème 4
L'étiquette d'une bouteille d'eau minérale indique la
concentration massique (mg/L) des principaux ions présents :
calcium ( 10,4) ; nitrate ( 4,0) ; sulfate ( 6,7 ) ;
magnésium ( 6,0) ; sodium ( 8,0) ; hydrogénocarbonate ( 64,0) ;
potassium ( 5,4) ; chlorure ( 7,5)
- Donner la formule de chacun de ces ions.
- Calculer leur concentration en mol/L.
- Vérifier l'électroneutralité de l'eau, compte tenu de
la précision des mesures.
- Donner la définition de la dureté de l'eau.
- Calculer le degré hydrotimétrique de cette eau ( 1°TH correspond à 10-4
mol/L d'ion calcium).
Préciser les inconvénients d'une eau dure dans les usages domestiques.
Ca : 40 ; K : 39 ; N : 14 ; S : 32 ; Mg : 24 ; Na : 23 ; Cl : 35,5 ; O
: 16 ; H : 1 g/mol.
corrigé
|
ion
|
calcium Ca2+
|
nitrate NO3-
|
sulfate SO42-
|
magnésium
Mg2+
|
sodium Na+
|
hydrogénocarbonate
HCO3-
|
potassium K+
|
chlorure Cl-
|
|
titre massique g/L
|
10,4 10-3
|
4,010-3
|
6,7 10-3
|
6,0 10-3
|
8,0 10-3
|
64 10-3
|
5,4 10-3
|
7,5 10-3
|
|
masse molaire M (g/mol)
|
40
|
62
|
96
|
24
|
23
|
61
|
39
|
35,5
|
|
concentration molaire (mol/L)
titre massique /M
|
10,4 10-3 / 40
=2,6 10-4
|
4,010-3 / 62
=6,45 10-5
|
6,98 10-5
|
2,5 10-4
|
3,48 10-4
|
1,05 10-3
|
1,38 10-4
|
2,11 10-4
|
électroneutralité de l'eau :
2[Ca2+]+2[Mg2+]+[Na+] +[ K+]= 5,2 10-4 + 5 10-4 +3,48
10-4 +1,38 10-4 =1,5 10-3.
[NO3-]+2[SO42-]
+ [HCO3-]+[Cl-]=6,45
10-5 + 13,96 10-5+1,05 10-3
+ 2,11 10-4 =1,47 10-3comparable
à 1,5 10-3.
La dureté d'une eau
est donnée par la concentration totale en ion calcium et en ion
magnésium : [Ca2+] + [Mg2+] = 5,1 10-4 mol/L
On définit le titre
hydrotimétrique (°TH) par : 1° TH = 10-4 mol/L.
degré hydrotimétrique de cette eau : 5,1 °TH
Les inconvénients d'une eau dure dans les
usages domestiques :
Un lavage inefficace
: l'eau dure empêche le savon de mousser.
Les dépôts de
calcaire dans la plomberie d'eau chaude.
problème 5 :
Le produit de
solubilité de l'hydroxyde de magnésium est Ks= 6
10-12 à 298 K. Quelle quantité d'hydroxyde de
magnésium peut-elle être dissoute dans :
- 1 L d'eau distillée
;
- dans 1 L de
solution 10-2 mol/L de chlorure de magnésium. Mg
: 24 ; H : 1 ; O : 16 g/mol
corrigé
Mg(OH)2
(s) = Mg2+ aq + 2 HO- aq
; Ks = [Mg2+][HO-]2
; on pose s = [Mg2+]
solution
électriquement neutre : [HO-] =2[Mg2+]=
2 s d'où Ks= 6 10-12 =
s(2s)²= 4s3 soit s = 1,14 10-4
mol/L
M(Mg(OH)2)=
24+2*17=58 g/mol
Dans 1 L d'eau
distillée ou peut dissoudre : 58*1,14 10-4 = 6,6
10-3 g d'hydroxyde de magnésium.
dans 1 L de
solution 10-2 mol/L de
chlorure de magnésium : [Mg2+]0=
0,01 mol/L ; [Cl-]0= 0,02
mol/L ; [Mg2+] = 0,01 + s'
solution
électriquement neutre : [HO-] +[Cl-]=2[Mg2+]
; [HO-] =2[Mg2+]-[Cl-]
= 2(0,01+s') -0,02 = 2s'
Ks=
6 10-12 = (0,01 + s') 4s'² ;
hypothèse faite
s'<<0,01 d'où Ks voisin de 0,04 s'2
= 6 10-12 soit s' = = 1,22 10-5
mol/L( l'hypothèse faite est vérifiée)
masse d'hydroxyde de
magnésium dissout : 58* 1,22 10-5 =7,1 10-4
g.
|
|
Problème
6 : pile Leclanché
A- Dans cette pile l'électrolyte est un gel contenant du
chlorure d'ammonium NH4Cl.
- L'ion ammonium est acide. Quelle est sa base
conjuguée ? Ecrire la demi-équation correspondante.
- Cette pile est-elle saline ou alcaline ? Justifier.
B- La pile Leclanché peut aussi impliquer les couples Zn2+/Zn
(E°= -0,76 V) et MnO2/MnO2H
(E°= 1,5 V).
- Ecrire les deux demi-équations électroniques des
couples oxydant / réducteur précédents en milieu basique pour le couple
avec MnO2.
- En fonction des potentiels, en déduire la polarité de chaque
électrode ( dont vous préciserez le nom) et écrire la réaction de
fonctionnement de la pile.
- On met en contact une masse m1
= 20 g de zinc et une masse m2 = 0,97 g d'oxyde
de manganèse. Déterminer la composition de l'état final.
- Combien d'électrons ont-ils été échangés au cours de
la réaction ?
- Cette pile débite un courant de 50 mA pendant 1 h 30
min. Calculer la quantité d'électricité parcourant le circuit, en
coulomb et en ampèreheure (Ah).
- En déduire la diminution de la masse de l'électrode de zinc. (
150 mA dans le texte original, valeur imcompatible avec 0,97 g MnO2
ou 1h 30)
- En déduire le temps de fonctionnement de la pile.
e = 1,6 10-19 C ; NA=
6,02 1023 mol-1 ; 1F=
96500 C mol-1 ; Zn : 65,4 ;Mn : 54,9 ; O : 16 ;
H: 1 g/mol
corrigé
base conjuguée de NH4+
: NH3 ; NH4+
= H+ +NH3
pile saline ; dans
une pile alcaline, l'électrolyte est une base.
demi-équations électroniques des couples
oxydant / réducteur :
Zn = Zn2+ + 2e-
: oxydation du zinc ( donc anode) libérant des électrons ( borne
négative de la pile)
2MnO2+2 e-
+2H2O = 2MnO2H
+2 HO- réduction ( donc cathode)
réaction de fonctionnement de la pile
: 2 MnO2+ Zn +2H2O
= 2MnO2H +2 HO-+
Zn2+
composition de l'état final :
n0(MnO2) =
m2/M(MnO2) =0,97 / 86,9
=1,116 10-2 mol ;n0(Zn) =
m1 / m(Zn) =20/65,4=0,306 mol
|
|
avancement (mol)
|
2 MnO2
|
+Zn
|
+2H2O
|
=2MnO2H
|
+2 HO-
|
+ Zn2+
|
|
initial
|
0
|
1,116 10-2
|
0,306
|
solvant en grande quantité
|
0
|
0
|
0
|
|
en cours
|
x
|
1,116 10-2 -2x
|
0,306-x
|
2x
|
2x
|
x
|
|
fin
|
xmax
= 5,58 10-3 mol
|
1,116 10-2 -2xmax
=0
|
0,306-xmax
=0,3 mol
|
2xmax =1,116 10-2
|
2xmax =1,116 10-2
|
xmax
= 5,58 10-3 mol
|
xmax = 1,116 10-2 /2 =
5,58 10-3 mol
électrons échangés au cours de la réaction
: n(e-) =5,58 10-3 mol
soit 5,58 10-3 NA = 5,58
10-3* 6,02 1023 = 3,36 1021
électrons.
le temps de fonctionnement de la pile
: 3,36 1021 e = 3,36 1021*1,6
10-19 = 538 C
avec une intensité de 0,05 A t = 538 / 0,05 = 10760 s
environ 3h.
quantité d'électricité parcourant le circuit en
1h30 = 5400 s : ( si I = 0,05 A)
Q= It = 0,05*5400 =270 C ou bien 0,05*1,5 = 0,075 Ah
diminution de la masse de l'électrode de zinc
: n(e-) = 270/96500 = 2,8 10-3 mol
or Zn = Zn2+ + 2e-
: d'où n(zinc) = ½n(e-) = 1,4 10-3 mol
masse (g) = Qté de matière (mol) * masse molaire (g/mol)
= 1,4 10-3 *65,4 = 0,091 g.
|
|
problème
7 : la morphine
La morphine extraite du pavot a la structure ci-contre :
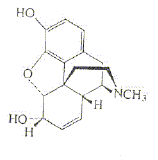
- Indiquer le nom des diverses fonctions présentes sur
cette molécule.
- Dans quelle condition pourra-t-on extraire la
morphine en solution aqueuse ? Quel sera le nom général du composé
formé dans ce cas ?
corrigé
phénol :
groupe OH fixé sur le cycle benzenique
alcool secondaire
-CH(OH)- ; amine tertiaire >N-CH3 ;
fonction époxyde ( cycle avec un atome d'oxygène)
extraire la morphine en solution aqueuse en présence d'acide chlorhydrique.
le nom général du composé formé dans ce cas : chlorhydrate de morphine.
|
|
problème
8
LUne expérience d'estérification est réalisée en
mélangeant une mole d'alcool ROH et une mole d'acide R1COOH.
Les groupes R et R1 sont des motifs alkyles
acycliques.
- Le mélange est de 164 mL. Alors que la réaction n'est
pas terminée, 10 mL du mélange sont prélevés. Il faut 24,4 mL d'une
solution molaire d'hydroxyde de sodium pour neutraliser l'acide présent
dans la prise d'essai. Calculer la quantité d'ester (mole) formé
pendant la réaction..
- Dans un but analytique, on oxyde totalement l'ester
formé sous forme de dioxyde de carbone et d'eau en présence d'oxyde
cuivrique jouant le rôle de catalyseur. 0,65 g d'ester conduit à 0,63 g
d'eau. En déduire la formule brute ainsi que la masse molaire de
l'ester.
- L'alcool utilisé pour la préparation de l'ester est
un alcool tertiaire. Indiquer les formules semi-développées des esters
possibles ainsi que leur nom. C: 12 ; H : 1; O : 16 g/mol
corrigé
quantité
d'ester formé :
A l'équivalence du dosage acide base, la quantité de
matière de soude est égale à la quantité de matière d'acide restant :
n( acide) = 24,4 10-3*1 = 2,44 10-2
mol.
acide restant dans 164 mL de mélange : 2,44 10-2
*164/10 = 0,395 mol
quantité de matière d'ester formé : 1-0,395 = 0,605 mol.
formule brute et masse molaire de l'ester
:
Cn H2nO2
: formule brute de l'ester
Cn H2nO2
+ (1,5 n-1) O2 --> n CO2
+ n H2O
Qté de matière d'eau : n(eau) = 0,63/18 = 0,035 mol d'où
n(ester) = 0,035/n mol
M( ester) = 14 n +32 g/mol ; n(ester) = m / M= 0,65
/(14n+32) =0,035/n.
0,65 n = (14n+32)*0,035 ; 0,65 n = 0,49 n+1,12 ; n = 7
C7H14O2
; M= 130 g/mol
formules semi-développées possibles :
CH3-CH2-COO-C(CH3)3
propanoate de 1,1-diméthyléthyle.
CH3-COO-C(CH3)2-CH3
éthanoate de 1,1-diméthylpropyle.
CH3-COO-CH(CH3)-CH(CH3
)2 éthanoate de 1,2-diméthylpropyle.
HCOO-C(CH3)2-CH2-CH2-CH3
méthanoate de 2,2-diméthylbutyle. éthanoate de
2,2-diméthylpropyle.
HCOO-CH(CH3)-CH(CH3)-CH2-CH3
méthanoate de 1,2-diméthylbutyle.
HCOO-CH(CH3)-CH2-CH(CH3)-CH3
méthanoate de 1,3-diméthylbutyle.
méthanoate de 2,3-diméthylbutyle ; méthanoate de
1,1-diméthylbutyle.
|
|
L'eau
de Javel
- Citer deux applications ménagères de l'eau de Javel ?
- Parmi les ions ci-dessous, indiquer ceux que l'on
trouve dans l'eau de Javel. Quel est celui qui constitue le principe
actif de l'eau de Javel ?
Na+ ; Cu2+ ; Cl-
; NO3- ; SO42-
; ClO-.
L'action d'un acide sur l'eau de Javel provoque un dégagement gazeux.
Donner la formule et le nom du gaz.
- Ecrire les demi-équations d'oxydo-réduction et l'équation bilan de la
réaction.
- Sur un flacon d'eau de Javel on lit : 48 degrés
chlorométriques ; densité d=1,22
Sachant que le degré chlorométrique d'une eau de Javle est le volume (
L) de dichlore ( mesuré dans les CNTP) que peut libérer 1 L de
solution, calculer la molarité de cette solution.
- Calculer le pourcentage en masse d'hypochlorite de sodium, de cette
eau de Javel.
A partir du contenu du flacon on prépare une solution aqueuse diluée
que l'on souhaite doser. Soit C0 la
concentration en ion hypochlorite de la solution préparée. On réalise
un dosage par iodomètrie afin de trouver C0.
Dans un bécher on verse 10 mL de la solution d'eau de Javel diluée. Une
solution d'iodure de potassium est ajoutée en excès. On acidifie la
solution obtenue. Tous les ions hypochlorites sont réduits en ions
chlorures.
- Ecrire les demi-équations concernant chacun des couples mis en jeu et
l'équation bilan de la réaction se produisant dans le bécher. Préciser
la couleur de la solution après réaction.
Le diiode formé est dosé par une solution de thiosulfate de sodium à
0,2 mol/L. On ajoute dans le bécher quelques gouttes d'empoi d'amidon.
- Préciser son rôle.
- Pour décolorer le mélange réactionnel il faut ajouter 26,8 mL de
solution de thiosulfate de sodium. Ecrire l'équation du dosage et
déterminer C0. Calculer le degré chlorométrique
de cette solution diluée.
- Proposer une préparation d'un litre de cette solution diluée à partir
du flacon à 48 degrés chlorométriques.
corrigé
applications
ménagères de l'eau de Javel : agent blanchiement et
désinfectant ( bactéricide)
ions que l'on trouve dans l'eau de Javel : Na+
; Cl- ; ClO-.
le principe actif de l'eau de Javel est du à l'ion
hypochlorite ClO-.
L'action d'un acide sur l'eau de Javel provoque
un dégagement gazeux de dichlore Cl2.
ClO- / Cl2
: 2ClO-+ 2e- + 4H+
= Cl2 + 2H2O
Cl2 /Cl-
: 2 Cl- = Cl2 + 2e-
2ClO-+2 Cl-+
4H+ = 2Cl2 + 2H2O
molarité de cette solution : n
(dichlore) = 48 / Vmolaire =48 / 22,4 = 2,14
mol/L
pourcentage en masse d'hypochlorite de sodium
: masse de 1 L de solution 1220 g
M( NaClO) = 23 + 35,5 + 1+ 16= 75,5 g/mol
2ClO-+2 Cl-+
4H+ = 2Cl2 + 2H2O
d'où : n(ClO-) = n(Cl2) =
2,14 mol
masse hypochlorite de sodium dans 1 L : 2,14 * 75,5 =
161,6 g soit 161,6*100/1220 = 13,2 %
demi-équations concernant chacun des couples
mis en jeu et l'équation bilan de la réaction se produisant dans le
bécher :
I2/I- : 2I-
= I2 + 2e- ;
ClO- /Cl-
: ClO- + 2H+ +2e-=Cl-+H2O
ClO- + 2H+
+2I- = I2 +Cl-+H2O
(1) ( couleur
jaune brune dûe au diiode)
L'empoi d'amidon joue le rôle d'indicateur de fin de
réaction.
équation du dosage : 2S2O32-
+ I2 = S4O62-
+ 2I- d'où n(I2) =½n(S2O32-)
n(S2O32-)
= 26,8 10-3*0,2 = 5,36 10-3
mol ; n(I2) = 2,68 10-3
mol
d'après (1)
: n(I2) = n(ClO-)=2,68 10-3
mol dans 10 mL soit C0= [ClO-]=
0,268 mol/L.
volume de dichlore obtenu : 0,268*22,4 = 6 l ou 6 degrés
chlorométriques.
préparation d'un litre de cette solution diluée
à partir du flacon à 48 degrés chlorométriques :
facteur de dilution F= 48/6 = 8
fiole jaugée de 1 L ; prélever 1000/8 = 125 mL de la
solution mère avec une pipette jaugée ou une burette graduée. Compléter
avec de l'eau distillée jusqu'au trait de jauge. Agiter pour rendre
homogène.
|
|
retour
-menu
|

