|
|
||||
|
||||
|
A- Dosage du peroxyde d'hydrogène dans une solution commerciale d'eau oxygénée : 10 mL d'une solution commerciale S1 sont dilués par de l'eau dans une fiole jaugée de 200 mL pour fournir une solution S2. 10 mL de cette solution S2 sont mis dans un erlenmeyer contenant une solution d'iodure de potassium en excès et 5 mL d'acide sulfurique.
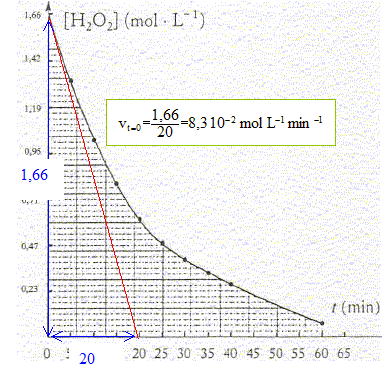
B- On se propose de suivre la disparition du peroxyde d'hydrogène au cours de sa décomposition selon la réaction (1) précédente. Cette expérience est réalisée à température ambiante. Le graphe représente l'évolution de la concentration en peroxyde d'hydrogène en fonction du temps. 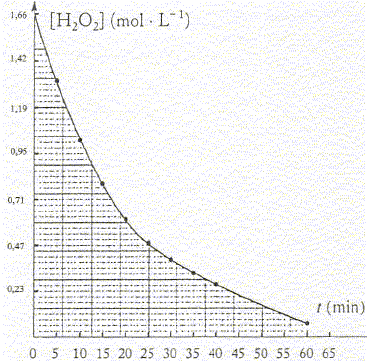
Données : Vm=22,4 L/mol ; I2/I- (E°=0,54 V) ; S4O62- /2S2O32- (E°=0,07 V) ; H2O2/H2O (E°=1,77 V).
H2O2+2H++2e- =2H2O réduction ; 2I- = I2+2e- oxydation H2O2+2H++2I- = I2+2H2O (1) équation bilan du dosage du diiode par le thiosulfate : 2S2O32-
= S4O62-+2e-
oxydation ; I2+2e- =2I-
réduction n(S2O32-) = 13,85 10-3*0,12 = 1,66 10-3 mol ; n(I2) = 8,3 10-4 mol d'après (1) : n(I2) = n(H2O2)= 8,3 10-4 mol dans 10 mL de S2. molarité en eau oxygénée des solutions S2 puis S1: [H2O2]S2 = 8,3 10-4/10-2 = 8,3 10-2 mol/L facteur de dilution F= 200/10 = 20 d'où [H2O2]S1 =20 [H2O2]S2 = 20* 8,3 10-2= 1,66 mol/L titre "en volume" de la solution commerciale : d'après H2O2--> H2O+½O2, n(O2) = ½n(H2O2) = 1,66/2 = 0,83 mol dans 1L 0,83*volume molaire des gaz = 0,83*22,4 = 18,6 volumes. vitesse moyene de disparition du composé dans l'intervalle de temps [15 ; 30 min] : vmoy = | [H2O2]30-[H2O2]15| / (30-15) = |0,40-0,80|/15= 0,4/15 = 2,7 10-2 mol L-1 min-1. vitesse instantanée de disparition de
H2O2 :
v=- 1/V dx/dt avec V: volume de la solution (L) et x avancement de la
réaction ; v= -d[H2O2]/dt cette vitesse diminue au cours du temps car la concentration ( facteur cinétique) d'eau oxygénée diminue au cours du temps.
|
||||
|
|