|
|
||||
|
||||
|
On extrait le thé d'un échantillon de 25 g, par de l'eau chaude contenant du carbonate de sodium. La solution aqueuse obtenue, refroidie, est extraire par du dichlorométhane. Après décantation, séchage et évaporation de la phase organique, un résidu est obtenu. On ajoute à celui-ci de l'acide salicylique dans un rapport pondéral de 10/8( caféine/acide salicylique). Le mélange obtenu est dissout à chaud par du dichlorométhane. On complète ensuite par de l'hexane jusqu'à obtention d'un trouble. La solution obtenue est refroidie à 0°C puis filtrée. Après séchage, une masse de 0,257 g d'un solide cristallin ( salicylate de caféine) est obtenue. 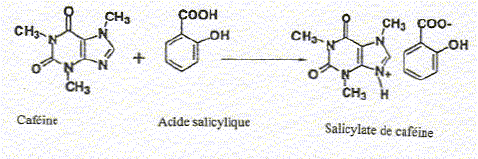
acide salicylique ou acide 2-hydroxybenzoïque ajout du carbonate de sodium avant la première extraction : l'ion carbonate CO3- est une base ; les fonctions acides carboxyliques des tanins sont transformées en ion carboxylate, ce qui augmente la solubilité des tannins dans l'eau. L'acide salicylique utilisé est-il en excès ou en défaut ? masse caféine / masse acide salicylique = 10/8 = 1,25 ; M( caféine) = 194 g/mol ; M(acide salicylique) = 138 g/mol n( caféine) = mcaféine / 194= 5,2 10-3mcaféine mol ; n( acide salicylique) = macide salicylique / 138 = mcaféine / (1,25*138) = 5,8 10-3mcaféine mol la réaction s'effectue mole à mole : donc l'acide salicylique est en excès. poids de caféine pour 100 g de thé : M( salicylate de caféine) = 138+194= 332 g/mol n( salicylate de caféine) = 0,257 / 332 = 7,74 10-4 mol donc masse de caféine dans 25 g de thé : 7,74 10-4*194 = 0,150 g ; soit 0,6 g dans 100 g et en tenant compte du rendement : 0,6/0,8 = 0,75 g. La recristallisation permet de purifier une espèce solide. On utilise un solvant dans lequel le solide à purifier est soluble à chaud et très peu soluble à froid ; par contre les impuretés à éliminer sont solubles à chaud comme à froid. On laisse lentement refroidir l'ensemble et on récupère les cristaux solide purifiés.
|
||||
|
|