|
|
|||||||||||||||||||||||||
|
|||||||||||||||||||||||||
|
Problème 2 Pour réaliser le dosage des ions nitrate et nitrite, les réactifs suivants doivent être préparés :
|
|||||||||||||||||||||||||
|
L'étiquette d'une bouteille d'acide sulfurique concentré indique : M=98,07 g/mol ; d= 1,84 ; titre : 97%
corrigé Masse de 1L de solution du commerce : 1840 g masse d'acide pure : 1840*0,97 =1794,8 g concentration molaire : 1784,8 / 98,07 =18,2 mol/L Facteur de dilution : F=18,2 / 0,73 =24,93 volume à prélever :1 /F = 1/24,93 =0,040 L = 40 mL Prélever 2 fois 20 mL à l'aide de la pipette jaugée ; placer dans la fiole jaugée de 1L contenant un peu d'eau distillée ; compléter jusqu'au trait de jauge avec de l'eau distillée. En utilisant une pipette jaugée, on prépare une solution de concentration très précise. Pour vérifier
la valeur exacte de cette concentration,
effectuer un titrage avec une solution titrée d'hydroxyde de sodium.
Le traitement chimique d'une molécule halogénée A comportant un atome de chlore conduit à un alcane B et à de l'acide chlorhydrique. L'alcane contient en masse : 84,4% de carbone.
corrigé Formule brute de B : CnH2n+2 ; 12 n / 84,4 = M/100 avec M= 14n+2 ; (14n+2)*0,844 = 12 n d'où n = 9. A--> B +HCl d'où B s'identifie à C9H2n+1Cl. B ne peut conduire qu'à deux dérivés monochlorés distincts : B possède deux types d'atomes d'hydrogène d'où (CH3)3C-CH2-C(CH3)3 2,2,4,4-tétraméthylpentane A peut être : (CH3)3C-CHCl-C(CH3)3 3-chloro- 2,2,4,4-tétraméthylpentane ou bien ClH2C-C(CH3)2-CH2-C(CH3)3 1-chloro 2,2,4,4-tétraméthylpentane
|
|||||||||||||||||||||||||
|
On extrait le thé d'un échantillon de 25 g, par de l'eau chaude contenant du carbonate de sodium. La solution aqueuse obtenue, refroidie, est extraire par du dichlorométhane. Après décantation, séchage et évaporation de la phase organique, un résidu est obtenu. On ajoute à celui-ci de l'acide salicylique dans un rapport pondéral de 10/8( caféine/acide salicylique). Le mélange obtenu est dissout à chaud par du dichlorométhane. On complète ensuite par de l'hexane jusqu'à obtention d'un trouble. La solution obtenue est refroidie à 0°C puis filtrée. Après séchage, une masse de 0,257 g d'un solide cristallin ( salicylate de caféine) est obtenue. 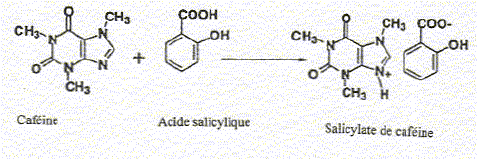
corrigé carbonate de sodium : Na2CO3 ; dichlorométhane : CH2Cl2. acide salicylique ou acide 2-hydroxybenzoïque ajout du carbonate de sodium avant la première extraction : l'ion carbonate CO3- est une base ; les fonctions acides carboxyliques des tanins sont transformées en ion carboxylate, ce qui augmente la solubilité des tannins dans l'eau. L'acide salicylique utilisé est-il en excès ou en défaut ? masse caféine / masse acide salicylique = 10/8 = 1,25 ; M( caféine) = 194 g/mol ; M(acide salicylique) = 138 g/mol n( caféine) = mcaféine / 194= 5,2 10-3mcaféine mol ; n( acide salicylique) = macide salicylique / 138 = mcaféine / (1,25*138) = 5,8 10-3mcaféine mol la réaction s'effectue mole à mole : donc l'acide salicylique est en excès. poids de caféine pour 100 g de thé : M( salicylate de caféine) = 138+194= 332 g/mol n( salicylate de caféine) = 0,257 / 332 = 7,74 10-4 mol donc masse de caféine dans 25 g de thé : 7,74 10-4*194 = 0,150 g ; soit 0,6 g dans 100 g et en tenant compte du rendement : 0,6/0,8 = 0,75 g. La recristallisation permet de purifier une espèce solide. On utilise un solvant dans lequel le solide à purifier est soluble à chaud et très peu soluble à froid ; par contre les impuretés à éliminer sont solubles à chaud comme à froid. On laisse lentement refroidir l'ensemble et on récupère les cristaux solide purifiés.
|
|||||||||||||||||||||||||
|
A- Dosage du peroxyde d'hydrogène dans une solution commerciale d'eau oxygénée : 10 mL d'une solution commerciale S1 sont dilués par de l'eau dans une fiole jaugée de 200 mL pour fournir une solution S2. 10 mL de cette solution S2 sont mis dans un erlenmeyer contenant une solution d'iodure de potassium en excès et 5 mL d'acide sulfurique.
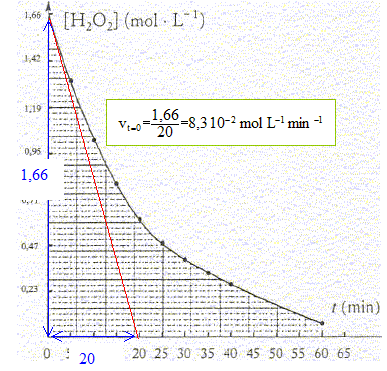
B- On se propose de suivre la disparition du peroxyde d'hydrogène au cours de sa décomposition selon la réaction (1) précédente. Cette expérience est réalisée à température ambiante. Le graphe représente l'évolution de la concentration en peroxyde d'hydrogène en fonction du temps. 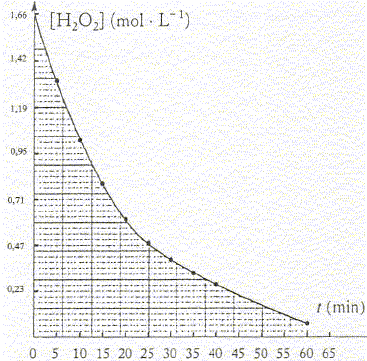
Données : Vm=22,4 L/mol ; I2/I- (E°=0,54 V) ; S4O62- /2S2O32- (E°=0,07 V) ; H2O2/H2O (E°=1,77 V). corrigé équation bilan de l'oxydation des ions iodures par l'eau oxygénée, en milieu acide : H2O2+2H++2e- =2H2O réduction ; 2I- = I2+2e- oxydation H2O2+2H++2I- = I2+2H2O (1) équation bilan du dosage du diiode par le thiosulfate : 2S2O32-
= S4O62-+2e-
oxydation ; I2+2e- =2I-
réduction n(S2O32-) = 13,85 10-3*0,12 = 1,66 10-3 mol ; n(I2) = 8,3 10-4 mol d'après (1) : n(I2) = n(H2O2)= 8,3 10-4 mol dans 10 mL de S2. molarité en eau oxygénée des solutions S2 puis S1: [H2O2]S2 = 8,3 10-4/10-2 = 8,3 10-2 mol/L facteur de dilution F= 200/10 = 20 d'où [H2O2]S1 =20 [H2O2]S2 = 20* 8,3 10-2= 1,66 mol/L titre "en volume" de la solution commerciale : d'après H2O2--> H2O+½O2, n(O2) = ½n(H2O2) = 1,66/2 = 0,83 mol dans 1L 0,83*volume molaire des gaz = 0,83*22,4 = 18,6 volumes. vitesse moyene de disparition du composé dans l'intervalle de temps [15 ; 30 min] : vmoy = | [H2O2]30-[H2O2]15| / (30-15) = |0,40-0,80|/15= 0,4/15 = 2,7 10-2 mol L-1 min-1. vitesse instantanée de disparition de
H2O2 :
v=- 1/V dx/dt avec V: volume de la solution (L) et x avancement de la
réaction ; v= -d[H2O2]/dt cette vitesse diminue au cours du temps car la concentration ( facteur cinétique) d'eau oxygénée diminue au cours du temps.
|
|||||||||||||||||||||||||
|
Dans les flacons contenant des cosmétiques, datant de l'Egypte ancienne, les omposés suivants ont été trouvés. Compléter le tableau : ( réponses écrites en bleu)
|
|||||||||||||||||||||||||
|
On dispose d'une solution B d'acide benzoïque de concentration CB= 2,5 10-2 mol/L et d'une solution C d'acide chlorhydrique de concentration CC= 1 10-3 mol/L.
corrigé acide benzoïque est un acide faible : pour un acide fort : pH=-log c ; pour un acide faible pH>-log c cas de l'acide benzoïque : -log c= - log 2,5 10-2 =1,6 ; pH mesuré = 2,9 ; l'acide benzoïque est donc un acide faible. coefficient d'ionisation a= [H3O+]/CB=10-pH / CB= 10-2,9 / 2,5 10-2 = 0,050. coefficient d'ionisation "a1" : facteur de dilution : F= 1000 / 10 = 100 ; CB1= 2,5 10-4 mol/L a1= [H3O+]/CB1=10-pH / CB1= 10-3,9 / 2,5 10-4 = 0,50. Par dilution, un acide faible se rapproche d'un acide fort ( la dissociation de l'acide faible augmente par dilution) coefficient d'ionisation "a2" : facteur de dilution : F= 200 / 100= 2 ; CB2= 1,25 10-4 mol/L a2= [H3O+]/CB2=10-pH / CB2= 10-3,25 / 1,25 10-2 = 0,045. quantité nb d'ion oxonium résultant de l'ionisation de l'acide benzoïque dans ce mélange : nB= 10-pH*(0,1+0,1) =10-3,25 *0,2 =1,12 10-4 mol C6H5COOH + H2O= H3O++C6H5COO- en ajoutant un acide ( des ions oxonium) on déplace l'équilibre précédent vers la gauche. pH d'une solution tampon qui contient 0,01 mol d'acide benzoïque( Ka= 6,6 10-5) et 0,01 mol de benzoate de sodium pH=pKa + log ([C6H5COO-]/[C6H5COOH] = 10-pKa + log 1 = 4,18. caractéristiques d'une solution tampon : le pH ne varie pas par dilution; modère les variations de pH lors de l'ajout modéré d'une quantité d'ion oxonium ou hydroxyde.
|
|||||||||||||||||||||||||
|
|