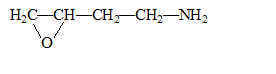|
|
|||||||||||||||||||||||
|
|||||||||||||||||||||||
corrigé AZX : A symbole de l'élément chimique ; Z numéro atomique, nombre de charge, nombre de proton ; A : nombre de masse, nombre de nucléons 13153I : 53 protons et 131-53 = 78 neutrons 13253I : 53 protons et 132-53 = 79 neutrons Pour la détection du fonctionnement de la thyroïde, on choisit 13253I, de période 2,3 heures : ce radioélément à pratiquement disparu de l'organisme 24 heures après l'examen du fait de sa courte période. Sa période est néanmoins assez longue pour que l'activité diminue peu au cours de l'examen ( 15 min ) On fait ingérer au malade 1 mg d'iode, la masse de radioélément-nucléide, exprimée en g, présente dans le corps au bout d'un temps équivalent à 4 périodes vaut : 0,5 m g au bout d'une période ; 0,25 m g au bout de 2 périodes ; 0,125 m g au bout de 3 périodes ; 0,0625 mg au bout de 4 périodes. Soit en mole : masse (g) / masse molaire iode 132 ( g/mol) =6,25 10-8 / 132 =4,7 10-10 mol ou 4,7 10-7 mmol. |
|||||||||||||||||||||||
|
L'acide nitreux HNO2 n'existe pas à l'état libre. On le prépare "in situé par action de l'acide chlorhydrique sur le nitrite de sodium, à une température inférieure à 6°C.
corrigé réaction de formation de l'acide nitreux NaNO2 + HCl ( concentré) --> HNO2 + NaCl. formules de Lewis : En milieu acide ( excès de HCl), l'acide nitreux donne l'ion nitrosonium : protonation de l'acide nitreux puis élimination d'une molécule d'eau et formation de l'ion nitrosium HNO2 + H+ ---> H2O + +NO NO2 est responsable de la formation de vapeurs rousses. NO2 est obtenu par oxydation du monoxyde d'azote NO.
|
|||||||||||||||||||||||
|
Un flacon d'acide orthophosphorique commercial porte les indications suivantes : H3PO4 : 98 g/mol ; pourcentage en masse : 85 % ; densité d = 1,69.
corrigé concentration molaire de la solution commerciale en H3PO4 : masse de 1 L de solution : 1690g ; masse d'acide pur dans 1 L : 1690*0,85 = 1436,5 g Quantité de matière (mol ) masse (g) / masse molaire (g/mol) = 1436,5 / 98 = 14,7 mol dans 1L. préparer 1 L d'une solution d'acide orthophosphorique de 0,1 mol/L : facteur de dilution F= concentrationmère / concentration fille = 14,7 / 0,1 = 147 volume pipette graduée (mL) ( ou burette graduée) = volume fiole jaugée ( 100 mL) / F = 1000 / 147 = 6,8 mL Utiliser une blouse, des gants et lunettes de protection ; travailler sous hotte. Prélever 6,8 mL de la solution commerciale à l'aide d'une pipette graduée ; verser dans la fiole jaugée contenant de l'eau distillée ; compléter jusqu'au trait de jauge avec de l'eau distillée ; agiter pour rendre homogène. En cas de projections sur les mains, laver à grande eau.
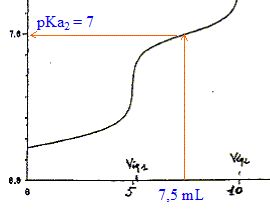
L'électrode de verre a toutes les qualités pour effectuer des mesures de pH. On utilise une électrode " combinée " , association d' une électrode de référence (chlorure d’argent) et d'une électrode de verre dont le potentiel dépend de la concentration en ions oxonium dans la solution de mesure. Le pHmètre doit être étalonné à partir de deux solutions tampons ( pH=7 et pH= 4 par exemple) Les différentes parties de cette courbe de dosage : de 0 à 5 mL de soude ajouté : dosage de la première acidité de l'acide othophsphorique. de 5 à 10 mL de soude ajouté : dosage de la seconde acidité de l'acide othophsphorique.
concentration exacte de la solution d'acide orthophosphorique : Le dosage d'une acidité nécessite 5 mL de soude à 1 mol/L et la prise d'essai est égale à 50 mL d'où : C= 5*0,1 / 50 = 0,1 mol/L couples acide base présents : HPO42- / PO43- ( pKa = 12,3) et H2O / HO- ( pKa = 14) PO43- + H2O = HPO42- + HO- constante d'équilibre K= [HPO42-][HO-] / [PO43-]=10 (-14+12,3) = 0,02 Calcul du pH d'une solution décimolaire de phosphate trisodique : établir un tableau d'avancement sur 1 L de solution
0,02(0,1-xéq) = x²éq ; x²éq +0,02 xéq -0,002 = 0 la résolution donne xéq = 3,6 10-2 ; [HO-]= 3,6 10-2 et [H3O+] = 10-14 / [HO-]=10-14 / 3,6 10-2 = 2,8 10-13 mol/L ; pH = - log(2,8 10-13)= 12,6.
|
|||||||||||||||||||||||
corrigé selon Brönsted : acide : espèce, ion ou molécule susceptible de céder un proton H+. base : espèce, ion ou molécule susceptible de gagner un proton H+. selon Lewis : acide : espèce susceptible d'accepter une paire (un doublet) d’électrons ( espèce électrophile, possédant une lacune électronique dans sa structure) base : espèce susceptible de céder une paire (un doublet) d’électrons ( espèce nucléophile, possédant un doublet électronique libre dans sa structure) L'aminobenzène ( aniline) est une base plus faible que la éthylamine : le doublet de l'atome d'azote est peu disponible, car il est délocalisé sur le noyau benzénique. Le doublet de l'azote s'engage dans la mésomérie avec le noyau benzénique. L'acide dichloroéthanoïque Cl2CH-COOH est plus fort que l'acide éthanoïque CH3COOH : les deux atomes de chlore sont attracteurs d'électrons et en conséquence la densité électronique autour de l'atome d'hydrogène du groupe COOH est plus faible ; ce dernier est plus disponible.
|
|||||||||||||||||||||||
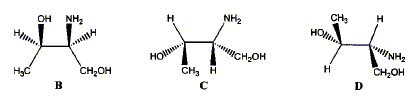
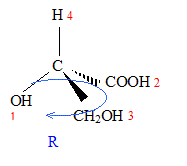
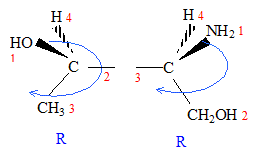
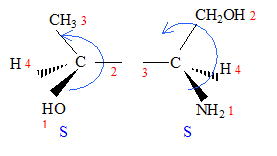
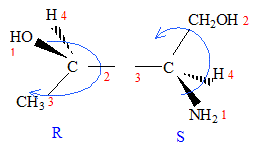
corrigé A est un acide dihydroxylé, deux groupe OH fixés sur deux atomes de carbone tétragonaux. le nom de A en nomenclature officielle : acide 2,3-dihydroxypropanoïque. la stéréochimie du carbone asymétrique
: numéroter de façon décroissante chacun des quatre substituants selon son numéro atomique. OH (1) ; COOH (2) ; CH2OH (3) ; H (4). On place alors l'atome (ou le groupement) de numéro le plus élevé derrière. On regarde dans quel sens, sens horaire ou trigonométrique, on passe du numéro 1, au 2, au 3. - Si le sens de rotation est le sens horaire (ou anti-trigonométrique), le carbone est Rectus (R), - Si le sens de rotation est le sens trigonométrique (ou
anti-horaire), le carbone est Sinister (S).
énantiomères : molécules images l'une de l'autre dans un miroir diastéréoisomères : ils ne diffèrent que par la configuration absolue d'un seul centre chiral ( dans le cas présent)
|
|||||||||||||||||||||||
|
L'analyse élémentaire d'un composé organique ne renfermant que du carbone, de l'hydrgène, de l'oxygène et de l'azote a donné les résultats suivants : C : 55,1 % ; H : 10,5% ; N : 15,9 %. La détermination du poids moléxulaire par cryométrie a été effectué sur 1 g de substance dissous dans 100 g d'acide éthanoïque. L'abaissement du point de congélation a été de Dq= 0,45°C. Celui-ci est donné par la loi de Raoult : Dq= KC/M où K=39, constante cryoscopique de l'acide éthanoïque, C : concentration de la substance en g dans 100 g de solvant, M : masse molaire du composé.
corrigé Formule brute du composé : CxHyOzNt avec x, y, z, t nombres entiers. masse molaire M= 12 x+y+16z+14t. 12x/55,1 = y / 10,5 = 16z / 18,5= 14 t / 15,9 = M/100 de plus Dq= KC/M donne M= KC / Dq = 39*1/0,45 = 86,7 ; voisin 87 g/mol. par suite t = 15,9*0,867 / 14 = 1 ; z= 18,5*0,867/16 = 1 ; y=10,5*0,867 = 9 ; x = 0,867/55,1/12 = 4 C4H9ON. amide : CH3-CH2-CH2-CONH2. fonction amine et fonction aldehyde : H2N-CH2-CH2-CH2-CHO cycle à trois chainons : examen du spectre de masse et présence du nombre d'atomes d'azote dans le composé : utiliser la règle de l'azote : si la masse de la molécule est paire alors il y a un nombre pair d'azote. utiliser les abondances isotopiques relatives par rapport au pic le plus important : 1,1 pour le carbone 13 et 0,38 pour l'azote 15. IM et IM+1 étant les abondances relatives du pic de l'ion moléculaire et du pic à M+1. 100IM+1 / IM=1,1 nC + 0,38nN avec nC, nombre de carbone et nN nombre d'azote.
|
|||||||||||||||||||||||
|
corrigé Un composé hydrophobe ne peu pas créer des liaisons hydrogène avec les molécules d'eau ; sa polarité est nulle ou très faible. Un composé hydrophile ou polaire est soluble dans l'eau, mais insoluble dans les corps gras. La chromatographie d'exclusion (encore appelée filtration sur gel ou tamisage moléculaire ) repose tou d'abord sur la masse molaire des molécules à séparer. La chromatographie d'absorption en phase inversée : la phase stationnaire est apolaire. ( silices apolaires greffées, greffons de 2 à 18 atomes de carbone (C2 à C18), c'est à dire de polarités différentes). La phase mobile est polaire et hydrophile. Les séparations mettent en oeuvre les interactions hydrophobes entre les molécules à séparer et la phase fixe. En conséquence, plus un soluté est apolaire, plus il il sera retenu sur la phase solide fixe. Inversement, plus le soluté est polaire, plus il est entraîné par la phase mobile liquide. La chromatographie ionique ( échange d'ions) : la colonne est constituée d'une résine chargée soit positivement (séparation des anions) soit négativement (séparation des cations). L'éluant, phase liquide, emporteions à séparer : la séparation des ions dépend de l'interaction électrostatique entre la résine de la colonne et les ions. La phase normale est constituée de gel de silice très polaire. On utilise un éluant apolaire. Ainsi les produits polaires sont retenus sur la phase fixe,alors que les produits apolaires sortent en premier.
La longueur de la chaine carbonée de ces trois acides est à peu près identique : l 'acide linoleïque possédant deux liaisons doubles C=C est le plus polaire ; l'acide arachidique ne possédant pas de liaison double C=C et ayant la plus longue chaîne carbonée sera le moins polaire. acide linoleïque : CH3(CH2)4CH=CH-CH2-CH=CH-(CH2)7-COOH acide arachidique : CH3(CH2)18COOH
|
|||||||||||||||||||||||
|
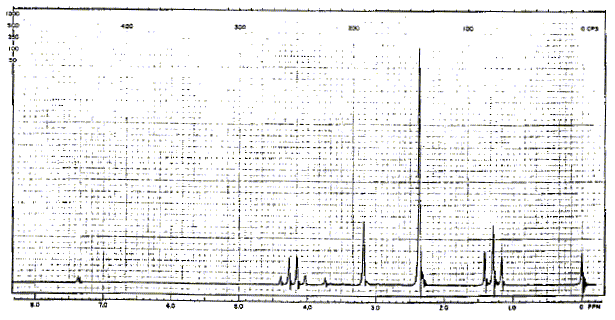
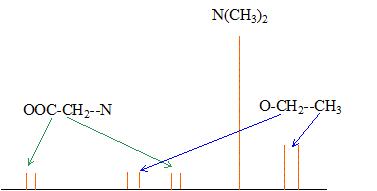
Le singulet à 3,1 ppm correspond à un groupe CH2 : les atomes situés en a ne portent pas d'hydrogène Le quadruplet ( 3 voisins) à 4,2 ppm et le triplet ( 2 voisins) à 1,3 ppm correspondent à -CH2-CH3. Le quadruplet à 4,2 ppm correspond à un déblindage important d'où un carbone lié à un atome d'oxygène : on identifie donc -O-CH2-CH3. par suite : (CH3)2N-CH2-COO-CH2-CH3. spectre RMN du carbone 13 :
|
|||||||||||||||||||||||
|
L'éthoxyéthane ( oxyde de diéthyle ou éther diéthylique), le tétrahydrofuranne et le 1,4-dioxane sont des solvants très utilisés en chimie.
corrigé éther diéthylique : CH3-CH2--CH2-CH3. 
Facilement inflammable. Irritant pour les yeux et les voies respiratoires. Le sulfate de magnésium anhydre permet d'éliminer les traces d'eau d l'éther. benzène : substance cancérogène pour l'homme.On choisira donc le toluène. |
|||||||||||||||||||||||
|
|
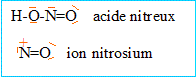

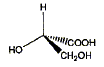 A est-il un acide monohydroxylé, dihydroxylé,
trihydroxylé ?
A est-il un acide monohydroxylé, dihydroxylé,
trihydroxylé ?