|
|
On désire vérifier les grandeurs caractéristiques
d'une tension alternative sinusoïdale délivrée par un GBF.
-
Dans la liste suivante barrer les appareils
inutiles : oscilloscope ; voltmètre ;
ohmètre
; ampèremètre ; teslamètre ;
fréquencemètre.
-
Parmi les appareils de cette liste un seul
permet de déterminer les deux grandeurs caractéristiques désirées.
Lequel ? oscilloscope.
-
Parmi les grandeurs caractéristiques suivantes
quelles sont celles qu'il peut permettre de déterminer directement ?
fréquence ; tension crête à crête
, période, tension
efficace.
On
désire tracer la caractéristique d'un conducteur ohmique.
-
Faire le schéma du montage utilisé en faisant
apparaître les éléments suivants : générateur, potentiomètre,
conducteur ohmique, ampèremètre et voltmètre.
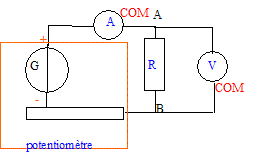
-
Le conducteur ohmique porte les indications
suivantes : puissance maximale admissible 0,25 W ; résistance 240 W. Vaut-il mieux fournir aux
élèves un générateur de fem 6 V ou 2 V ? Justifier.
La tension maximale admissible aux bornes du résistor est :
P= U I et U= RI soit I= U/R ; d'où P= U²/R ; U²= PR ; U= racine carrée
(PR) = rac.carrée (0,25*240 ) = 7,7 V
il faut donc fournir le générateur de fem 6 V.
-
On dispose d'une
solution de permanganate de potassium obtenue en dissolvant 15,8 g de
solide dans 1 L d'eau. La solution ainsi obtenue s'appelle S0.
-
Quelle est la concentration molaire de cette
solution ?M( KMnO4) = 158 g/mol.
Quantité de
matière (mol) = masse (g) / masse molaire (g/mol) = 15,8 / 158 = 0,10
mol.
concentration (mol/L) = quantité de matière (mol) / volume (L) = 0,1 /
1 = 0,1 mol/L.
-
On désire
maintenant préparer 200 mL d'une solution titrée S à partir de S0,
en diluant celle-ci d'un facteur F=20. Indiquer dans la liste suivante
le matériel à utiliser : fiole jaugée de 500 mL, 200 mL 100 mL ;
pipettes jaugées de 100 mL 20 mL 10 mL ; éprouvette graduée de 100 mL
20 mL 10 mL
F= volume fiole
jaugée / volume pipette jaugée = 20
d'où fiole jaugée 200
mL, pipette jaugée 10 mL
Pour réaliser la synthèse d'un ester (
éthanoate de 3-méthylbuthyle) on désire chauffer à reflux pendant une
heure le mélange réactionnel, extraire la phase organique à l'aide
d'une ampoule à décanter et enfin distiller cette phase pour récupérer
l'ester.
-
Pour le
chauffage à reflux on a besoin d'un : chauffe ballon,
bec
bunsen, thermomètre,
ballon, colonne Vigreux, réfrigérant à
boules ( rayer les mentions inutiles)
-
L'ester
obtenu a une densité d= 0,87 et est peu soluble dans l'eau. Lorsque le
mélange réactionnel est versé dans l'ampoule à décanter il est
additionné d'eau. Faut-il récupérer la phase supérieure ou la phase
inférieure ? Justifier.
Il faut
récupérer la phase organique contenant l'ester ; l'ester a une densité
inférieure à celle de l'eau ; l'ester occupe la partie supérieure
et la phase aqueuse, la partie inférieure.
-
On distille
la phase récupérée. Quel(s) instrument(s) de la liste précédente
faut-il rajouter ? colonne
Vigreux
|