|
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
L’acide benzoïque, de formule semi-développée C6H5COOH, est utilisé comme conservateur dans l’industrie alimentaire. On le notera dans l’exercice AH. On peut déterminer la concentration d’une solution S d’acide benzoïque en menant un dosage acide-base par une solution d’hydroxyde de sodium (soude) fraîchement préparée, de concentration connue : [NaOH] = 0,05 mol.L-1. Pour ce faire, on prélève à l’aide d’une pipette graduée 50,0 mL d’une solution d’acide benzoïque, que l’on verse dans un bécher. Après avoir équipé ce dernier d’un système d’agitation et d’un pH-mètre, on introduit progressivement la solution de soude à l’aide d’une burette graduée et on porte la valeur indiquée par le pH-mètre en fonction du volume de soude ajouté. 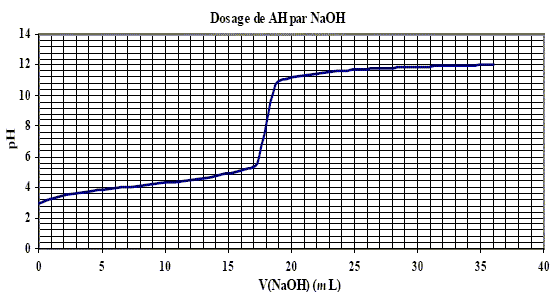
équation de la réaction de dosage : C6H5COOH + HO- = C6H5COO- + H2O ; K= [C6H5COO- ]/([C6H5COOH][HO-]) pKa du couple AH/A- : à la demi équivalence du dosage, pH=pKa soit pKa = 4,2 ( lecture graphe à V=½Véq = 9 mL). constante d’équilibre de la réaction de dosage : C6H5COOH + H2O = H3O+ + C6H5COO- ; Ka =[C6H5COO-][H3O+]/[C6H5COOH] soit [C6H5COO-]/[C6H5COOH] = Ka / [H3O+] repport dans K : K= Ka/([HO-][H3O+]) = Ka/Ke = 10-4,2 / 10-14 = 109,8 . La réaction est rapide, totale et exothermique. pH à l’équivalence : présence de la base ion benzoate, donc pH basique ( le graphe indique pHéq=7,6). le meilleur indicateur coloré pour ce dosage : le pH éq doit appartenir à la zone de virage de l'indicateur coloré, donc rouge de crésol. concentration en acide benzoïque de la solution S : [à l'équivalence, [NaOH] Véq = CaVa soit Ca = [NaOH] Véq / Va= 0,05*18/50 = 1,8 10-2 mol/L concentration en g.L-1 d’acide benzoïque = concentration molaire * masse molaire 1,8 10-2 * (7*12+6+32) = 2,2 g/L.
|
||||||||||||||||||||||||||||||
|
|