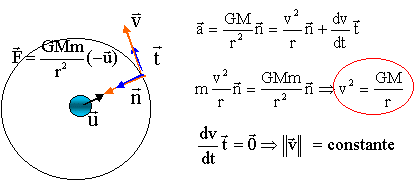|
d'après
concours controleur de la concurence
et de la répression des fraudes 2003
|
||||
|
||||
|
Un satellite de télécommunication, considéré comme ponctuel, a été placé sur orbite autour de la Terre. Afin de faciliter sa recherche, sa position est fixe par rapport au référentiel géocentrique. Il est constamment à la verticale du même point de la Terre. Ce satellite est géostationnaire.
Application numérique : Rayon de la Terre R = 6,37 103 km ; Masse de la Terre M = 6 1024 kg ; Constante de gravitation universelle G = 6,67 10-11 N.m2kg-2 Période de rotation de la Terre T = 8,62 104 s corrigé référentiel géocentrique : lié à la terre ; l'origine du repère est le centre de la terre ; les trois axes pointent vers des étoiles lointaines qui paraissent fixes. Le satellite géostationnaire tourne dans le plan équatorial, dans le même sens que la Terre, avec la même vitesse angulaire que la Terre. La Terre exerce une force de gravitation attractive sur le satellite, centripète ( dirigée vers le centre de la Terre), valeur F= GMm/(R+h)² ( m : masse du satellite et h : altitude du satellite par rapport au sol) Le satellite est soumis à la seule force de gravitation exercée par la Terre ; la seconde loi de Newton s'écrit sur l'axe n : ma = GMm/(R+h)² d'où l'accélération : centripète, valeur a= GM/(R+h)²
L'accélération étant centripète, la valeur de la vitesse est constante pour une altitude donnée : le mouvement est uniforme période T : La période est la durée pour pacourir une circonférence de rayon r =R+h à la vitesse v 2pr = vT 4p²r² = v²T² = GMT² / r T²
= r3 4p²/ (GM) d'où r3
=
T² GM / (4p²).
r3 = (8,62 104)² * 6,67 10-11 * 6 1024 / (4*3,14²) = 7,5 1022 d'où r = 4,22 107 m. altitude h = r-R= 4,22 107-6,37 106 =3,59 107 m
|
||||
|
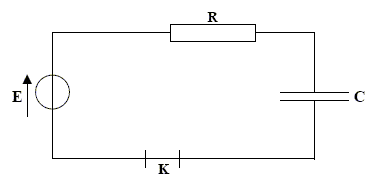
corrigé Un condensateur est constitué de deux armatures métalliques séparées par un isolant ou diélectrique.
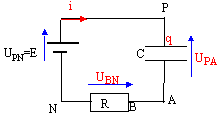
la charge q est positive ( armature reliée à la borne positive du générateur. La capacité notée C s'exprime en farad ( F) relation liant la charge q à l’intensité du courant i : i = dq/dt relation liant la charge q à la tension uC : q= CuC relation liant l’intensité i à la tension uC : i = CduC/dt UPN=E = UPA+UAN E = UC +Ri avec i = dq/dt = CdUC/dt = Cu'C. E = uC +RCu'C u'C + 1/(RC) uC =E / (RC) avec t = RC , constante de temps exprimée en seconde. uC(t) = A+B e-t/t ; dériver par rapport au temps : u'C =-B/t e-t/t ; repport dans l'équation différentielle : -B/t e-t/t + 1 /t (A+B e-t/t)=E //t soit A= E D'autre part à t=0, le condensateur n'est pas chargé et uC=0 soit A+B=0 ; par suite : B= - E uC(t) = E(1- e-t/t )
|
||||
|
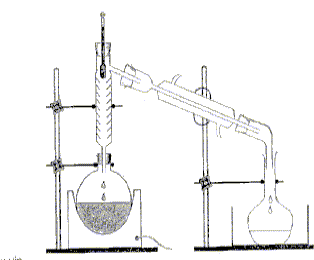
On distille E0 = 20,00 mL de cet apéritif additionné de 100 mL d’eau. Le distillat est recueilli dans une fiole jaugée de U = 250,0 mL. Lorsqu’on a 60 mL de distillat qui contient alors tout l’éthanol de la boisson alcoolisée, on complète avec de l’eau jusqu’au trait de jauge : soit S la solution obtenue.
DONNÉES M du sel de Mohr = 392,16 g.mol -1 ; M de l’éthanol = 46,0 g.mol -1 ; Masse volumique de l’éthanol à 20°C = 789 kg.m-3 Potentiels redox des couples CH3COOH / C2H5OH = 0.05 V ; Cr2O72- / Cr3+ = 1,36 V ; Fe3+ / Fe2+ = 0,77 V E(électrode au calomel à KCl saturé) / (électrode standard à hydrogène) = 0,245 V corrigé 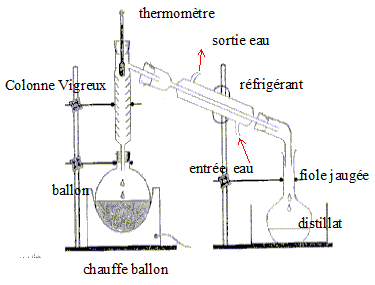
préparation de l’essai (E) : 3 fois { C2H5OH +H2O = CH3COOH + 4H+ + 4e- } oxydation alcool 2 fois { Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7 H2O } réduction de l'ion dichromate 3C2H5OH + 2Cr2O72- +16H+= 3CH3COOH + 4Cr3+ + 11 H2O (1) dosage du témoin (T) : 6 fois { Fe2+ = Fe3+ +e- } oxydation de l'ion fer II Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7 H2O Cr2O72- +6Fe2+ +14H+ = 6Fe3++ 2Cr3+ + 7 H2O (2) rôle de l’acide sulfurique : les ions oxonium H3O+ noté H+ ci-dessus, sont l'un des réactifs concentration C en ions fer (II) de la solution de sel de Mohr préparée : n(mol) = m (g)/ Mg/mol) = 20,98 / 392,16 = 5,35 10-2 mol C(mol/L) = n(mol) / V (L) = 5,35 10-2 /0,1 = 0,535 mol/L. nombre de moles de dichromate de potassium utilisés dans l’essai (E) et le témoin (T): d'après les coefficients de l'équation (2) : n( Fe2+ ) = 6 n(dichromate) n(dichromate) = 6 E2 C2 avec C2 : concentration en ion dichromate n( Fe2+ ) = CVE ( pour l'essai) et n( Fe2+ ) = CVT ( pour le témoin) essai : 6 n(dichromate) = CVE ; n(dichromate) = CVE /6 = 0,535*8,65 10-3 /6 = 7,71 10-4 mol de dichromate en excès témoin : n(dichromate) = CVT /6 = 0,535*23 10-3 /6 = 2,05 10-3 mol nombre de moles de dichromate de potassium ayant réagi lors de la préparation de l’essai (E) : CVT /6 -CVE /6 =(2,05-0,771) 10-3 = 1,279 10-3 mol nombre de moles d’éthanol dans la prise d’essai E1 : d'après les coefficients de l'équation (1) : n( alcool ) = 1,5 n(dichromate ayant réagi)= 1,5*1,279 10-3 = 1,918 10-3 mol titre alcoométrique de l’apéritif analysé : masse d'alcool dans 10 mL de S : m(g) = n(mol) * M(alcool) (g/mol) = 1,918 10-3 *46 =8,83 10-2 g volume d'alcool : m(g) / masse volumique (g/mL) = 8,83 10-2 /0,789 = 0,112 mL dans 10 mL de la prise donc 25*1,12=2,8 mL d'alcool pur dans 250 mL de S ou encore dans 20 mL d'apéritif soit 2,8*5 = 14 mL d'alcool pur dans 100 mL d'apéritif. ( 14°) les électrodes à utiliser : une électrode de référence (électrode au calomel à KCl saturé) et une électode de mesure ( graphite ou platine ) plongeant dans la solution. avant l'équivalence, les ions dichromate sont en excès, le couple Cr2O72- / Cr3+ fixe le potentiel de l'électrode de mesure : Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7 H2O E= 1,36 + 0,01 log ([Cr2O72-][H+]14/[Cr3+]2) après l'équivalence, les ions fer II sont en excès, le couple Fe3+ / Fe2+ fixe le potentiel de l'électrode de mesure : E = 0,77 + 0,06 log ([Fe3+]/[Fe2+])
|
||||
corrigé éthanol : CH3-CH2OH alcool primaire : l'atome porteur du groupe OH est relié à un seul carbone - CH2OH alcool secondaire : l'atome porteur du groupe OH est relié à deux atomes de carbone > CHOH alcool tertiaire :
l'atome porteur du groupe OH est relié à 3 atomes de carbone
peut s'oxyder en
aldehyde ( butanal H3C-CH2-CH2-CHO)
puis en acide butanoïque H3C-CH2-CH2-COOH
peut s'oxyder en aldehyde ( 2-méthylpropanal CH3-CH(CH3)-CHO ) puis en acide
2-méthylpropanoïque H3C-CH(CH3)-COOH
peut s'oxyder en cétone butanone CH3-CO-CH2-CH3 test positif avec la
DNPH,( solide jaune) et négatif avec Fehling.
Test commun aux aldéhydes et aux cétones. Les composés carbonylés (aldéhydes et cétones) se caractérisent à l'aide de la 2,4-dinitrophénylhydrazine (DNPH) avec laquelle ils donnent un précipité jaune-orangé de 2,4-dinitrophénylhydrazone. Tests spécifiques des aldéhydes. Liqueur de Fehling: Le chauffage modéré d'un mélange contenant de la liqueur de Fehling et un aldéhyde conduit à un précipité rouge brique (constitué d'oxyde de cuivre (I) Cu2O). Réactif de Tollens (solution de nitrate d'argent ammoniacal): Le chauffage modéré (50°C à 60°C au bain marie) d'un mélange de réactif de Tollens et d''aldéhyde dans une verrerie très propre conduit à la formation d'un miroir d'argent sur les parois de la verrerie. Réactif de Schiff (fuschine décolorée par le dioxyde de soufre): A froid et en milieu non basique, en présence d'un aldéhyde le réactif de Schiff prend une teinte rose- violacée.
|
||||
|
|