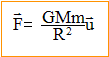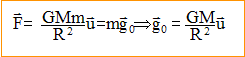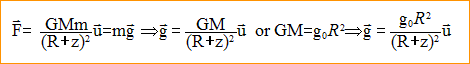|
|
|||||||||||||||||||||
|
|||||||||||||||||||||
|
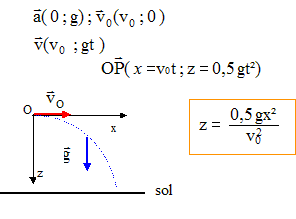
I. Citer : le principe d'inertie, la loi des actions réciproques, le théorème du centre d'inertie, le théorème de l'énergie cinétique ( 2pts) II. Chute libre (5 pts) Soit un solide dense de petites dimensions (une bille par exemple) de masse m = 20 g. Nous étudions la chute dans le référentiel terrestre considéré comme galiléen auquel nous lions le repère orthonormé (O, i, j, k). Le sol est situé à 0,80 m au-dessous du point O. On lâche (ou on lance ) le corps du point O, à une date choisie comme origine des dates. On néglige la résistance de l'air et on prend g =10 ms- 2 . Le champ de pesanteur est considéré comme uniforme dans le domaine de l'espace où évolue le solide.
corrigé principe d'inertie : dans un référentiel galiléen, si la somme vectorielle des forces extérieures appliquées à un solide est nulle ( solide pseudo-isolé ) alors le centre d’inertie G de ce solide est soit au repos, soit animé d'un mouvement rectiligne uniforme et réciproquement. théorème du centre d'inertie : dans un référentiel galiléen, la somme vectorielle des forces extérieures appliquées à un solide est égale au produit de la masse M du solide par l'accélération de son centre d'inertie. interaction entre un objet A et un objet B : (loi des actions réciproques) si un solide noté A exerce sur un solide noté B une force notée F A / B, alors B exerce sur A une force notée F B / A . Les deux forces associées à une même interaction sont toujours égales et opposées. théorème de l'énergie cinétique : dans un référentiel galiléen, pour
un solide ponctuel de masse m, lors d'un déplacement reliant un point A
à un point B, la variation d’énergie cinétique est égale à la somme des
travaux des forces extérieures qui s’exercent sur le solide.
équation horaire : z=½gt² = 5 t² temps mis par le corps pour atteindre le sol : t= racine carrée ( z/5) = racine carrée (0,8/5) = 0,4 s. vitesse du corps quand il atteint le sol : v= gt = 10 t
= 10*0,4 = 4 m/s.
vitesse du corps quand il atteint le sol : v = gt -v0 = 10t-3 et z = ½gt²-v0t = 5t²-3t éliminer le temps entre ces deux équations : t=0,1(v+3) ; z = 0,05 (v+3)²-0,3(v+3) changement de variable : V= v+3 ; z = 0,05 V²-0,3 V au sol z= 0,8 ; résoudre : 0,05 V² -0,3 V-0,8 = 0 ; V= 8 soit v= 5 m/s. temps mis par le corps pour atteindre le sol : v = 10 t-3 ; au sol v= 5 m/s ; t= (5+3) /
10 = 0,8 s.
|
|||||||||||||||||||||
|
corrigé L'interaction gravitationnelle (Newton 1867) entre les masses. Deux corps A et B de masses respectives mA et mB séparés d'une distance d exercent l'un sur l'autre des forces opposées attractives, importantes dans l'infiniment grand, négligeables dans l'infiniment petit.
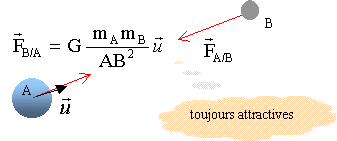
expression vectorielle de la force centripète
exercée par la Terre sur un solide de masse m, considéré comme ponctuel
et situé à sa surface : expression vectorielle du champ de gravitation g0
de la Terre à l'altitude z=0 m : M= g0R²/G = 9,8 *(6,4 106)²/ 6,67 10-11 = 6 1024 kg l'altitude z au-dessus de la Terre :
|
|||||||||||||||||||||
|
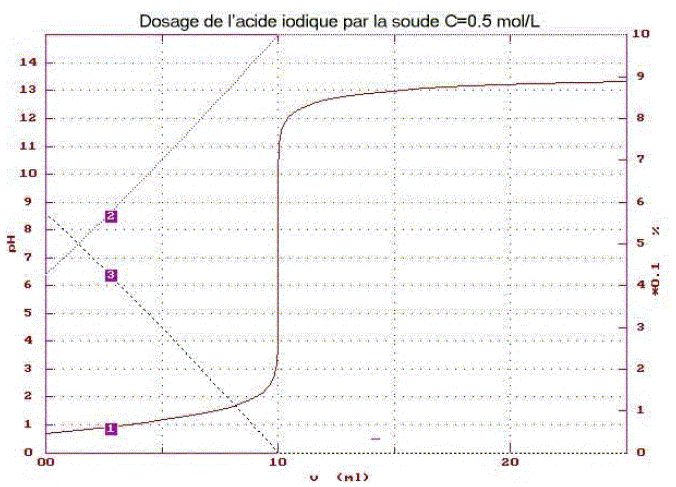
L’acide iodique HIO3 est un monoacide faible, dont la base conjuguée est l’ion iodate.
corrigé définition d’un acide : espèce ion ou molécule susceptible de céder un proton H+. définition d’une base : espèce ion ou molécule susceptible de gagner un proton H+. ion iodate IO3-. électrode combinée de pH intégrant une sonde de température Identifier les tracés 1 ; 2; 3 : 1 : courbe du dosage pH= f(volume de soude ajouté) 3 : fraction molaire de HIO3 ; 2 : fraction molaire IO3-. L'ordonnée de l'intersection des courbes 2 et 3 donne le pH à l'équivalence : pHe = 7,5 ; l'abscisse de l'intersection de la courbe 2 avec l'axe horizontal donne le volume de soude ajouté à l'équivalence Ve= 10 mL. constante d'acidité Ka : HIO3 + H2O = IO3- + H3O+. Ka = [IO3-][H3O+] / [HIO3] Le pH à la demi-équivalence donne la valeur du pKa soit pKa = 1,2 ( lecture graphe) : Ka = 10-1,2 = 6,3 10-2. équation de la réaction du dosage : HIO3 +HO- = H2O + IO3- K= [IO3-]/([HIO3][HO-]) avec [IO3-]/[HIO3] = Ka /[H3O+] K= Ka /([H3O+][HO-]) = Ka / Ke = 6,3 10-2 / 10-14 = 6,3 1012. cette valeur étant très grande, la transformation est totale concentration Ca de l’acide iodique : à l'équivalence les quantités de matière des réactifs sont en proportions stoéchiomètriques CaVa = Cb Ve soit Ca = Cb Ve / Va = 0,5*10 /10 = 0,500 mol/L ordre de grandeur du pHe : conservation élément iode : [IO3-]é + [HIO3]é = Ca --> [IO3-]é voisin Ca solution élecriquement neutre : [IO3-]é +[HO-]é =[ H3O+]é +[Na+]é [ H3O+]é négligeable devant [HO-]é et [Na+]é =Ca d'où [IO3-]é +[HO-]é =Ca soit [HIO3]é =[HO-]é =Ke / [ H3O+]é Or Ka = [IO3-][H3O+] / [HIO3] ; Ka =Ca[ H3O+]2é/Ke ; [ H3O+]2é=KaKe / Ca = 6,3 10-2*10-14/0,5 = 1,26 10-15 [ H3O+]é=3,5 10-8 ; pHe = 7,45.
|
|||||||||||||||||||||
|
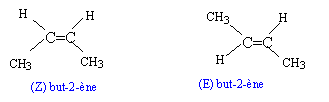
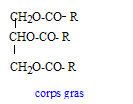
Le diiode de formule chimique I2 peut donner avec les alcènes des réactions d’addition pour donner un diiodo alcane. La réaction précédemment évoquée est lente, on ajoute donc au milieu réactionnel un catalyseur. C’est ce mode opératoire qui est mis à profit pour déterminer l’indice d’iode des corps gras. Les corps gras sont des triesters du glycérol (ou propanetriol) et d’un acide gras (acide à longue chaîne carbonée pouvant présenter des insaturations).
corrigé formule générale d’un alcène : CnH2n. but-1-ène CH2=CH-CH2-CH3 ; 2-méthylpropène CH2=C(CH3 )2
formule chimique du glycérol : HOH2C-CHOH-CH2OH formule semi-développée acide oléique : CH3-(CH2)7-CH=CH-(CH2)7-COOH formule des corps gras formés entre le glycérol et
l’acide oléique : l'acide oléique est noté R-COOH réaction chimique attendue si on fait réagir de l’huile de ricin avec un mélange de diiode et de catalyseur : addition de 3 moles de diiode ( par mole de corps gras) sur les trois doubles liaisons carbone carbone des trois chaînes carbonnées R R devient alors : CH3-(CH2)7-CH I-CH I-(CH2)7-
|
|||||||||||||||||||||
|
Protocole expérimental : Dans un bicol de 250 mL surmonté d’un réfrigérant à reflux et d’une ampoule de coulée et muni d’un système d’agitation magnétique, introduire 50 mL de butan-1-ol. Après l'introduction du butan-1-ol, introduire dans l'ampoule de coulée 30 mL d’acide acétique pur cristallisable et 15 gouttes d’acide sulfurique concentré. En agitant, couler lentement le mélange d’acides. Chauffer 1 heure à reflux tout en agitant. Refroidir à température ambiante puis couler le mélange réactionnel sur 100 mL d’eau glacée. Après lavages de la phase organique, séchage et distillation, on obtient l’acétate de butyle purifié. Questions :
corrigé équation chimique de la réaction : CH3-COOH + CH3-CH2-CH2-CH2OH = CH3-COO-CH2-CH2-CH2-CH3 +H2O quantités (en moles) de réactifs mis en jeu : butan-1-ol : masse (g) = volume (mL) * densité = 50*0,8098 = 40,49 g n(mol) = m(g) / M(butanol) (g/mol) = 40,49 / 74,12 = 0,546 mol. acide acétique ( même type de calcul ) : 30 *1,049 / 60,05 = 0,524 mol ( en défaut) On peut obtenir au mieux 0,524 mol d'ester soit une masse égale à 0,524*116,16 = 60,87 g soit un volume de : 60,87/ 0,8748 = 69,6 mL. volume d’acétate de butyle obtenu : volume théorique * rendement = 69,6 * 0,7 = 48,7 mL On chauffe le milieu réactionnel afin d'accélérer la réaction sans changer la composition du mélange à l'équilibre. l’acide sulfurique catalyse à la fois la réaction d'estérification et la réaction inverse, l'hydrolyse de l'ester : l'équilibre est atteint plus rapidement mais sa composition n'est pas modifiée.
|
|||||||||||||||||||||
|
|