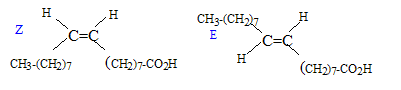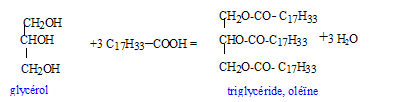|
|
||||
|
||||
|
Les deux diastéréoisomères :
La molécule n'est pas chirale : absence de carbone asymétrique.( carbone tétragonal portant 4 substituants différents) On fait réagir à chaud du glycérol avec un grand escès d'acide oléique. Il se forme un triglycéride, l'oléine et un composé non organique. estérification, lente, athermique, limitée par l'hydrolyse du triester
On utilise un excès d'acide oléique afin de déplacer l'équilibre vers la formation de l'ester ( obtention d'un meilleur rendement) On chauffe pour accélérer la réaction et atteindre plus rapidement l'équilibre.
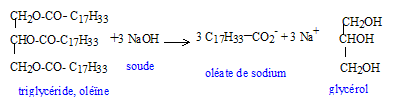
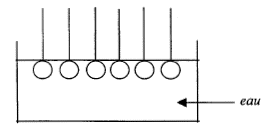
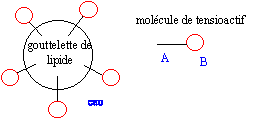
Cette réaction se modélise par l'action d'un réactif nucléophile sur un site électrophile ; représentation de Lewis de ce réactif nucléophile. réactif nucléophile HO- : masse de savon théoriquement obtenu en faisant réagir une masse d'oléine notée moléine avec un excès de soude. Les masses molaires de l'oléine et du savon sont notées Moléine et Msavon. n( oléine) =moléine / Moléine d'après les coefficients de l'équation : n( savon) =3 n( oléine) = 3moléine / Moléine or n( savon) =msavon / Msavon d'où msavon = 3 moléineMsavon / Moléine L'eau savoneuse : L'ion carboxylate du savon peut être représenté de la façon suivante ----------O dans lequel la partie rectiligne représente la chaîne carbonée et le cercle le groupe carboxylate. partie hydrophile : groupe COO- symbolysé par "O" et partie hydrophobe de cet ion : la chaîne carbonée symbolysée par "---------". ions carboxylates à la surface de l'eau : ions carboxylate sur une tache de graisse (lipide) :
|
||||
|
|