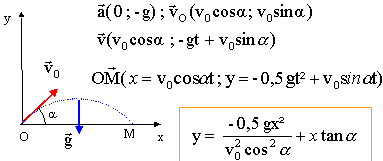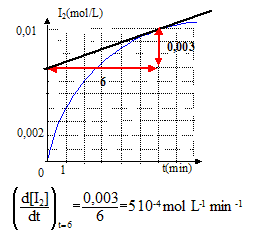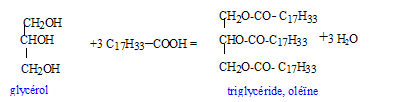|
|
|||||||||||||||||||
|
|||||||||||||||||||
|
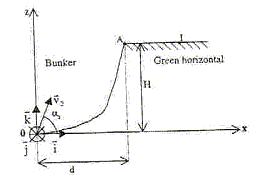
Un joueur utilise un club de golf et communique à la balle un vecteur vitesse v0 dans le plan vertical. A la date t=0 la balle, supposée ponctuelle et de masse m, part du popint O avec le vecteur vitesse v0. On néglige les frottements de l'air sur la balle ; on donne g= 10 m/s² ; H=d=1 m. Le référentiel lié à la terre est supposé galiléen. Dans un premier temps le joueur tente de lancer la balle le plus loin possible avec une vitesse v0 = 40 m/s. 
chute libre ( boulet soumis uniquement à son poids) avec vitesse initiale.
équation d'une branche de parabole
lorsque le boulet retombe sur le sol horizontal, y=0, l'abscisse est égale à la portée L. 0 = -½ gL² /(v0²cos²a) + L sin a / cosa. multiplier par cos a et diviser par : 0= -½gL/(v0²cosa) + sin a . ½gL/(v0²cosa) = sin a . L= 2 v0²cosa sin a/ g soit encore L = v0² sin (2a)/ g. portée maximale si sin (2a) = 1 soit a = 45°. Lmax
= v0²/g
= 40*40/10 = 160 m.
Au sommet de la trajectoire , le vecteur vitesse est horizontal : la composante suivant Oy est nulle. D' où tS= v0sin a / g. Puis on remplace le temps dans l'expression donnant l'ordonnée y et x. d'où : xS=v0 cos a v0sin a / g =v0² sin acos a / g = ½v0² sin (2a)/ g = ½L yS= -½g(v0sin a / g)² + v0sina v0sin a / g = ½v0²sin² a / g ; flèche maxi si a = 90°. flèche h0 pour a0 =45° ; h0
= 0,5 *40² sin²45 / 10 = 40 m
yA = -½g xA²/(v0cos a)² + xA tan a = -0,5*10*1²/(10 cos70)² + 1* tan 70 = 2,32 m valeur supérieure à H=1 m , donc la balle peut sortir du bunker. Expression littérale de la vitesse v1 de la balle en I : énergie mécanique initiale en O : ½mv0² ; énergie mécanique en I : ½mv1² +mgH conservation de l'énergie mécanique : ½mv0² = ½mv1² +mgH v1² = v0² -2gH ; v1 = (v0² -2gH)½.
|
|||||||||||||||||||
|
l'équation bilan est : H2O2 + 2I- +2H3O+= 4H2O+I2.
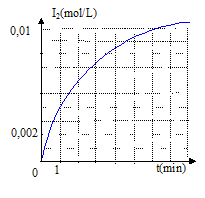
corrigé les deux demi-équations d'oxydo-réduction correspondant aux couples envisagés 2I- =I2 + 2e- oxydation H2O2 +2e- +2H3O+= 4H2O réduction l'équation bilan de la réaction : H2O2 + 2I- +2H3O+= 4H2O+I2. refroidir le tube avant le dosage du diiode : on réalise un blocage cinétique. Quantités de matière initiales : n0(H2O2)= V1 [H2O2] = 4*0,2 = 0,8 mmol n0(H3O+)= V3 [H3O+] = 1*1 = 1 mmol ; n0(I-)= V2 [I-] =5*0,1 = 0,5 mmol à partir de 0,8 mmol d'eau oxygénée il faut 1,6 mmol d'ion iodure et 1,6 mmol d'ion oxonium : or on ne dispose que de 0,5mmol d'ion iodure ; ce dernier est en défaut et constitue le réactif limitant. concentration en diiode dans un tube à la fin de la réaction : nf(I2 ) = ½n0(I-)= 0,25 mmol volume total du mélange : 4+5+1 = 10 mL ; [I2]f = 0,25/10= 2,5 10-2 mol/L Cette valeur n'est pas atteinte ( sur le graphe on lit à t= 6 min , [I2]f =10-2 mol/L) ; la réaction n'est pas encore terminée. rendement de la réaction en diiode formé à t = 6 min : concentration réelle / concentration thèorique *100 = 0,01 / 0,025 *100 = 40% vitesse de formation du diiode : 1/V dx/dt = d[I2]/dt avec V : volume du mélange réactionnel et x avancement (mol) valeur de la vitesse de formaton du diiode à la date t= 6 min
|
|||||||||||||||||||
|
Masse molaire M(HCOOH) = 46,0 g/mol ; pKa( HCOOH / HCOO-) = 3,8 à 25°C. Une solution commerciale S d'acide méthanoïque porte les indications suivantes : masse volumique m ; pourcentage massique en acide : p%.
corrigé concentration molaire volumique C de la solution S : masse volumique m en g/mL masse de 1 L de solution S : 1000 m g ; masse d'acide pur dans 1 L : 1000 m p/100 = 10m p g Qté de matière d'acide dans 1 L : masse (g) / Masse molaire (g/mol) = 10m p / M(HCOOH) mol dans 1 L verrerie utilisée pour prélever le volume V de solution S et pour préparer la solution S1 : pipette (+ pipeteur) de 50 mL relation liant les concentrations C et C1 : facteur de dilution F =V1/V = 500 / 50 = 10 de plus F= C/C1 = 10 d'où C= 10 C1. verrerie utilisée pour déterminer le volume Véq : burette graduée couples mis en jeu lors du mélange des solutions S et S0 par ordre de pKa décroissant : espèce majoritaires écrites en rouge avanr toute réaction
HCOOH + HO- --> HCOO- + H2O constante K1 de cette réaction : K1 = [HCOO-] / ([HCOOH][HO-]) or Ka = [HCOO-][H3O+]/[HCOOH] soit [HCOO-] / [HCOOH] = Ka /[H3O+] d'où : K1 = Ka /([H3O+][HO-])=Ka /Ke = 10-3,8 / 10-14 = 1010,2, valeur grande donc réaction totale. valeur de C1 : à l'équivalence V2C1=Véq C0 soit C1=Véq C0 / V2=24,4*0,1/10 = 0,244 mol/L Or C = 10 C1 = 2,44 mol/L. espèces majoritaires présentes dans le mélange réactionnel obtenu à l'équivalence :
HCOO- + H2O = HCOOH + HO- constante K2 = [HCOOH][ HO-]/[HCOO-] =1/K1 = 10-10,2 , valeur très faible, réaction très limitée. Le mélange réactionnel à l'équivalence contient la base [HCOO- : le pH est supérieur à 7 , milieu basique. La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent, d'où le choix de la phénolphtaléine.
|
|||||||||||||||||||
|
corrigé diastéréoisomères : 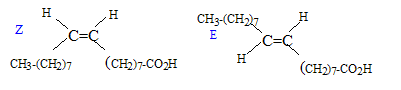
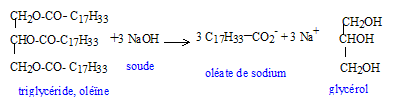
glycérol : HO-CH2-CHOH-CH2OH ( 2 fonctions alcool primaire et une fonction alcool secondaire). La molécule n'est pas chirale : absence de carbone asymétrique.( carbone tétragonal portant 4 substituants différents) estérification, lente, athermique, limitée par l'hydrolyse du triester
On utilise un excès d'acide oléique afin de déplacer l'équilibre vers la formation de l'ester ( obtention d'un meilleur rendement) On chauffe pour accélérer la réaction et atteindre plus rapidement l'équilibre.
saponification, lente mais totale :
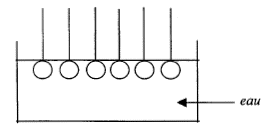
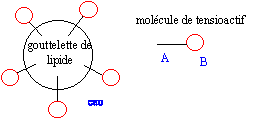
réactif nucléophile HO- : savon obtenu : oléate de sodium masse de savon théoriquement obtenu en faisant réagir une masse d'oléine notée moléine avec un excès de soude : n( oléine) =moléine / Moléine d'après les coefficients de l'équation : n( savon) =3 n( oléine) = 3moléine / Moléine or n( savon) =msavon / Msavon d'où msavon = 3 moléineMsavon / Moléine partie hydrophile : groupe COO- symbolysé par "O" et partie hydrophobe de cet ion : la chaîne carbonée symbolysée par "---------". ions carboxylates à la surface de l'eau : ions carboxylate sur une tache de graisse (lipide) :
|
|||||||||||||||||||
|
|