|
|
||||
|
||||
|
||||
|
||||
|
||||
|
||||
|
||||
|
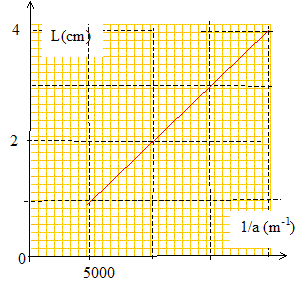
Le graphe ci-dessous représente la largeur L de la tache centrale en fonction de 1/a.
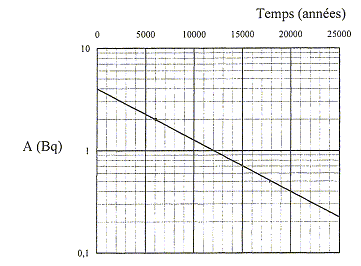
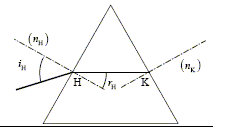
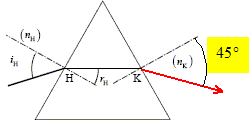
L'écart angulaire q sous lequel est vu la moitié de la tache centrale depuis l'objet diffractant est supposé petit. A. l = 500 nm. vrai. q = l/a = L/(2D) ; L =2Dl * (1/a) ; le coefficient directeur de la droite ci-dessus est égal à 2Dl = 0,01 /5000 = 2 10-6 m2. d'où l = 2 10-6 /4 = 5 10-7 m = 500 nm. B. q est proportionnel à a. faux. C. pour a = 800 mm, L= 1,6 cm. faux. aL =2Dl =2 10-6 m2 d'après le graphe. 800 10-6 *1,6 10-2 =12,8 10-6, valeur différente du coefficient directeur. D. pour a = 100 mm, q = 5 10-3 rad. vrai. q = l/a =5 10-7 / 100 10-6 = 5 10-3 rad. E. pour L = 2 cm, q = 10-2 rad. faux. q = l/a = L/(2D) = 0,02 / 4 =5 10-3 rad. Un faisceau lumineux incident traverse en H et K un prisme équilatéral. Lorsque iH= 45 ° le faisceau HK est horizontal. L'indice de l'air est égal à 1.
A. l'indice du prisme vaut 1,3. faux. Loi de Descartes pour la réfraction en H : sin 45 = n sin rH avec rH = 30° ; sin 30 = 0,5 n = 0,707/0,5 =1,41. B. pour iH=45°, le rayon sortant en K et le rayon incident ont la même direction. faux. Loi de Descartes pour la réfraction en K : n sin 30 = sin rK par suite iK=45°.
C. pour iH = 40,5°, rH~30°.faux. D. pour iH = 90°, rH~45°. vrai. Loi de Descartes pour la réfraction en H : sin 90 = 1,41 sin rH ; sin rH = 1/1,41 = 0,707 ; rH~45°. E. il existe un angle iH pour lequel on observe aucune réfraction. faux. Cela ne peut pas se produit quand on passe de l'air dans un verre, milieu plus réfringent que l'air. On réalise le titrage pHmétrique de 100 mL d'un acide AH par la soude NaOH à 0,02 mol/L. Au point équivalent on a versé 150 mL de soude et le pH vaut 8. A. la constante d'équilibre de la réaction s'écrit :[A-][H3O+] / [AH]. faux. AH + HO- = A- +H2O ; K = [A- ] / ([HO- ][AH]). B. la constante d'acidité s'écrit :[A-][H3O+] / [AH]. vrai. C. la concentration initiale de la solution de AH est 0,03 mol/L. vrai. A l'équivalence CAVA = CBVB ; CA= CBVB / VA =0,02*150/100 = 0,03 mol/L. D. au point équivalent [A-]= [AH]. faux. Cela n'est vrai qu'à la demi-équivalence. E. au point équivalent [Na+]=0,02 mol/L. faux. Il faut prendre en compte la dilution [Na+] = CBVB /(VA+VB) = 0,02*150/250 =0,012 mol/L.
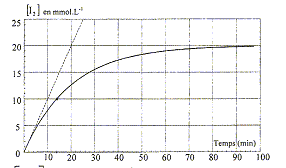
On étudie la cinétique de l'oxydation des ions iodure I- par l'eau oxygénée H2O2. L'équation bilan de la réaction s'écrit : H2O2 + 2I-+ 2H+ = I2+2H2O. Les concentrations nitiales sont : [I-]0=0,05 mol/L ; [H2O2]0=0,03 mol/L ; [H+]0=0,04 mol/L. Les mélanges sont réalisés à t=0 ; La température et le volume du mélange restent constants. d'après les coefficients de l'équation : n(I-) disparu = 2 n(I2) formé. B- H2O2 est le facteur limitant. faux Soit 1 L de solution ; à partir de 0,03 mol H2O2, on peut oxyder 0,06 mol I- ; or il n'y a que 0,05 mol d'ion iodure ; celui-ci est donc en défaut. C- Le temps de demi-réaction vaut 14 min. vrai à t½ l'avancement est égal à la moitié de l'avancement final ; lire l'abscisse correspondante à 10 mmol/L de I2. D- A t=0, la vitesse d'apparition du diiode est de 20 mmol L-1 min-1. faux coefficient directeur de la tangente à l'origine ; 20 / 20 = 1 mmol L-1 min-1. E- Lorsque t tend vers l'infini, [I-] tend vers 0,01 mol/L. vrai Soit 1 L de solution ; n(I2)oo=20 mmol ; n(I-)disparu = 40 mmol ; n(I-)oo= 50-40 = 10 mmol |
||||
|
|