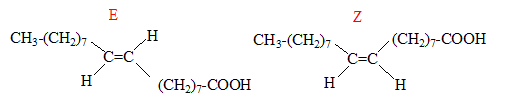|
|
||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||
corrigé Les coupes mis en jeu sont : I2 / I- : 2I- = I2 + 2e- oxydation H2O2/ H2O
: H2O2 + 2e- +
2H+= 2H2O réduction Il faut acidifier le milieu réactionnel car l'ion H+ est l'un des réactif. Il ne faut pas que l'anion apporté par l'acide ait des
propriétés oxydantes qui concurencerait H2O2.
n0(I-) =
10*0,2 = 2 mmol ; n0(H2O2)
= 2*0,2 = 0,4 mmol ; d'après les coefficients stoechiométrique de (1), 2 mol d'ion iodure réagissent avec une mol d'eau oxygénée donc 0,4 mmol d'eau oxygénée réagit avec 0,8 mmol d'ion iodure. Or nous disposons de 2 mmol d'ion iodure : ce dernier
est en excès de : 2-0,8 = 1,2 mmol. à partir de 0,4 mmol d'eau oxygénée il se forme 0,4 mmol de diiode ; volume du mélange : 30 mL = 0,03 L [I2]max =
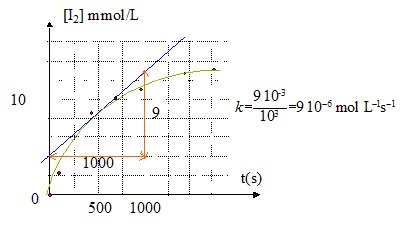
0,4/0,03 = 0,0133 mol/L
= 13,3 mmol/L
coefficient directeur de la tangente à la courbe ci-dessus à la date considérée. avec x : avancement (mol) et V : volume de la solution (L)
|
||||||||||||||||||||||||||||||||||||||
|
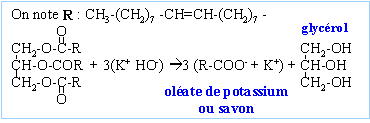
Données : oléine Mol= 884 ; savon : Ms= 304 g/mol ; masse volumique de l'oléine r= 0,88 kg/L. L'oléine est un corps gras de formule brute C57H104O6 présente dans l'huile d'olive. On souhaite fabriquer un savon à partir de celle-ci. Pour cela, on utilise le montage suivant : dans un ballon on introduit 20 mL de soude concentrée à 10 mol/L, 50 mL d'eau, 50 mL d'éthanol et 20 mL d'huile d'olive. On ajoute un barreau magnétique, puis on place le ballon sur un agitateur chauffant après l'avoir muni d'un réfrigérant vertical. On laisse la réaction de saponification se faire pendant 30 min. Après refroidissement, le mélange est versé dans une solution de chlorure de sodium, puis le savon est recueilli par écrémage.
corrigé L'acide oléique est l'acide gras de formule CH3-(CH2)7-CH=CH-(CH2)7-COOH. Il présent l'isomérie de type Z E ( diastéréoisomérie)
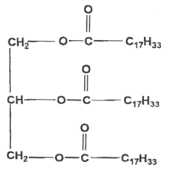
la formule semi-développée de l'oléine :
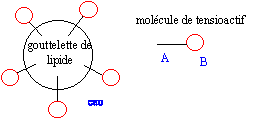
Schéma de l'action d'un savon peut agir sur une tache de graisse : partie hydrophile : groupe COO- symbolysée par "O" et partie hydrophobe de cet ion : la chaîne carbonée symbolysée par "---------".
ions carboxylate sur une tache de graisse (lipide) :
quantité de matière initiale (mol) : n0(soude) = 0,02*10 = 0,2 mol masse d'huile (g) = volume ( mL) * masse volumique ( g/mL) = 20*0,88 = 17,6 g n0( oléine )= 17,6 / 884 = 0,02 mol D'après les coefficients de l'équation bilan, à partir de 0,02 mol d'oléine il faut 0,02*3 = 0,06 mol de soude. Or nous avons 0,2 mol de soude : celle-ci est en excès
de 0,2-0,06 = 0,14 mol. ( oléine en défaut) D'après les coefficients de l'équation bilan, à partir de 0,02 mol d'oléine on obtient 0,02*3 = 0,06 mol de savon masse (g) = quantité de matière (mol) * masse molaire
(g/mol) = 0,06*304 = 18,2 g. le rendement de la réaction : masse réelle / masse théorique * 100 = 12,3/18,2*100 = 67,6 % ( 68 %).
|
||||||||||||||||||||||||||||||||||||||
|
|