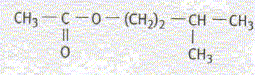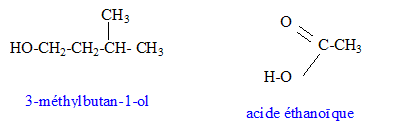|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
On donne l'équation de réaction suivante,ainsi que la constante d'équilibre associée : Cu(s) + Zn2+(aq) = Zn(s) + Cu2+(aq) ; K= 5,0 10-38.
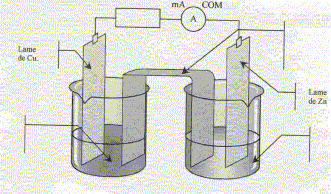
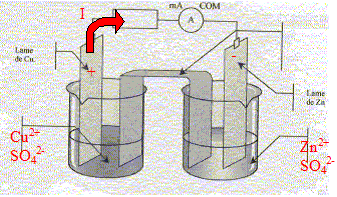
corrigé Sens d'évolution du système chimique : On trempe une lame de zinc et une lame de cuivre dans un becher contenant V1= 100 mL d'une solution de sulfate de cuivre (Cu2+ + SO42-), de concentration en ion Cu2+ donnée par [Cu2+]i = 0,5 mol/L et un volume V2= 100 mL d'une solution de sulfate de zinc (Zn2+ + SO42-) de concentration en ion Zn2+ donnée par [Zn2+]i = 0,5 mol/L. Inventaire des espèces chimiques présentes à l'état initial : H2O,
Cu(s), Zn(s), Zn2+ , SO42-,
Cu2+ Qr i
= [Cu2+]i / [Zn2+]i
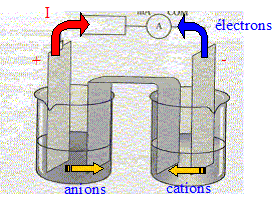
=1, valeur supérieure à K. Les branchements à réaliser pour mesurer une tension positive aux bornes de la pile : voltmètre en dérivation, borne COM sur le zinc ; borne "V" sur le cuivre Les porteurs de charges dans les électrolytes : les ions positifs ou cations : ils se déplacent dans le sens du courant. les ions négatifs ou anions : ils se déplacent en sens contraire du courant. et dans les métaux : les électrons ; ils se déplacent en sens contraire du courant
Les demi-équations électroniques mises en jeu aux électrodes : anode négative, oxydation du zinc : Zn(s) = Zn2+ + 2e-. cathode positive (
Cu), réduction de Cu2+ : Cu2+
+2e- = Cu(s) Les résultats trouvés sont en accord avec le critère d'évolution.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
L'arôme de banane est obtenu en synthétisant
un composé organique : l'acétate d'isoamyle
corrigé Le groupe caractéristique contenu dans l'acétate d'isoamyle : 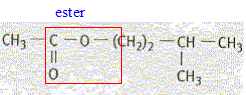
L'acétate d'isoamyle est obtenu à partir de l'acide éthanoïque et du 3-méthylbutan-1-ol. Les formules semi-développées de ces composés sont :
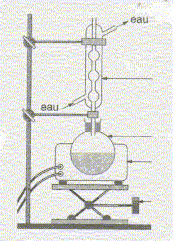
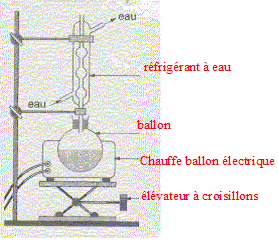
Equation chimique relative à la transformation chimique précédente : CH3-COOH + HO-CH2-CH2-CH(CH3)2 = CH3-COO-CH2-CH2-CH(CH3)2 +H2O Le signe = traduit le fait que l'on aboutit à un équilibre chimique. Ces caractéristiques cinétiques : lente, athermique, limitée par l'hydrolyse de l'ester. Chauffage à reflux :
Le taux d'avancement final est de 67 %. Taux d'avancement final d'une réaction : t = xfin
/ xmax avec x l'avancement (mol)
Masse d'acétate d'isoamyle obtenue(g) = Quantité de matière (mol) * masse molaire (g/mol) m= 0,67*150 = 2/3*150 = 100 g. Pour améliorer ce taux on modifie certaines conditions expérimentales :
expérience 2 : l'acide sulfurique est un catalyseur ; l'équilibre est plus rapidement atteint ( par rapport à l'expérience 0) mais la composition du mélange à l'équilibre n'est pas modifiée ( t inchangé) expérience 3 : l'acide sulfurique est un catalyseur ; la quantité de matière des réactifs est un facteur cinétique ; l'équilibre est plus rapidement atteint ( par rapport à l'expérience 0) et la composition du mélange à l'équilibre est modifiée ; en ajoutant l'alcool en excès, l'équilibre est déplacé vers la droite, formation de l'ester ( t augmente) On peut réaliser la synthèse en remplaçant l'acide par un autre composé organique. 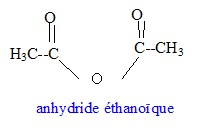 Equation bilan associée à la transformation chimique : [CH3-CO]2O
+ HO-CH2-CH2-CH(CH3)2
--> CH3-COO-CH2-CH2-CH(CH3)2
+CH3-COOH
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|