|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Le but de cet exercice est l'étude de la réaction de saponification obtenue en mélangeant à t=0, 250 mL d'une solution d'éthanoate de sodium CH3COO-C2H5 de concentration c1 = 10 mmol/L avec 250 mL d'une solution d'hydroxyde de sodium de même concentration. Méthode de suivi de l'évolution de la réaction : La réaction est lente ; la concentration en ion hydroxyde [HO-] dans le milieu diminue au cours du temps. On travaille dans un bain thermostaté pour maintenir la température constante. Dès que le mélange réactionnel est réalisé on soutire 8 échantillons de même volume V= 10 mL et on laisse évoluer ces 8 échantillons identiques. A la date t1 = 2 min, on dose par une solution d'acide chlorhydrique l'échantillon n°1, à la date t2 = 4 min, un second..... A la date du dosage ( juste avant de réaliser celui-ci ) on ajoute des glaçons. Dosage de l'ion hydroxyde à la date t : On effectue un dosage
colorimétrique des ions hydroxydes par une solution d'acide
chlorhydrique de concentration c2 = 1,0 10-3
mol/L.
Dosage des ions hydroxyde :
Cinétique :
corrigé Réaction de saponification : Equation de la réaction de saponification : CH3COO-C2H5 + HO- ---> CH3COO- + C2H5OH Noms des produits obtenus : ion éthanoate ( acétate) et éthanol Ces caractéristiques : lente mais totale Quantité initiale d'ion hydroxyde et la concentration initiale [HO-]0 : V1=250 mL d'une solution d'hydroxyde de sodium de concentration c1 = 10 mmol/L. n(HO-)
= V1 c1 = 0,25* 10 10-3
= 2,5 10-3 mol dans un volume final de 0,5 L ; [HO-]0 = 2,5 10-3
/0,5 = 5 10-3 mol/L = 5 mmol/L
Les deux bases présentes dans le milieu réactionnel sont : HO- et CH3COO- Equations relatives aux réactions de ces bases avec l'ion oxonium H3O+ : HO- + H3O+ = 2H2O ; K1= 1/([HO-][H3O+]) = 1/10-14 = 1014. CH3COO- + H3O+ = H2O + CH3COOH ; K2= [CH3COOH] / ([H3O+][CH3COO-]) or Ka = [CH3COO-][H3O+]/[CH3COOH] d'où : K2=1/Ka = = 1/ 10-4,75 = 104,75 = 5,6 104. K2<<K1 donc la réaction qui se produit en premier ( réaction de dosage) est celle mettant en jeu les ions hydroxydes. L'équivalence de cette réaction est obtenue pour un volume d'acide Véq versé. à l'équivalence : C2Véq = [HO-]V ; [HO-] =C2Véq /V=10-3Véq /10 = 10-4Véq mol/L = 0,1 Véq mmol/L avec Véq en mL
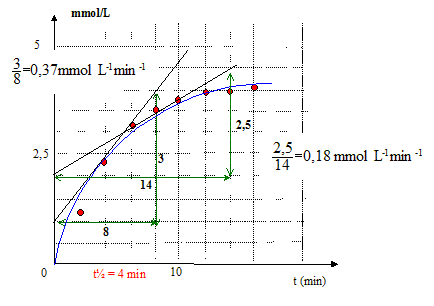
Un des produits formés lors de la réaction est de l'éthanol ; Relation donnant la concentration en éthanol en fonction de la concentration en ion hydroxyde : La quantité de matière (mol) d'ion hydroxyde disparu est égale à la quantité de matière (mol) formé : [éthanol]t=[HO-]0 -[HO-]t.
la limite de la courbe : le mélange initial est stoechiométrique ; au bout d'un temps très long, la réaction étant totale, la concentration en éthanol sera : 5 mmol/L le temps de demi-réaction t½ : temps au bout duquel l'avancement est égal à la moitié de l'avancement final ½tfin = 2,5 mmol d'éthanol Vitesse volumique intantanée de la réaction : v = 1/V dx/dt =d[éthanol]/dt coefficient directeur de la tangente à la courbe à la date considérée.
Composition du système à t = 2t½= 8 min [éthanol]=[CH3COO-]= 3,5 mmol/L ; [HO-] =[ester]=1,5 mmol/L la vitesse diminue au cours du temps : la concentration des réactifs est un facteur cinétique ; celle-ci diminue au cours du temps.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
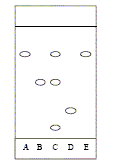
Principe : L'acide acéthylsalicylique est préparé par réaction entre l'acide salicylique et l'anhydride éthanoïque en présence d'acide sulfurique, selon la réaction : HO-C6H4-COOH + CH3-CO-O-CO-CH3 ---> CH3-CO-O-C6H4-COOH + CH3-COOH Etape 1 : On prépare un bain marie (50 - 60°C). Dans un erlenmeyer bien sec, on introduit successivement avec précaution 10,0 g d'acide salicylique, 15 mL d'anhydride éthanoïque mesurée avec une éprouvette graduée, 5 gouttes d'acide sulfurique concentré. On adapte un réfrigérant à boules sur l'erlenmeyer, puis on agite le mélange et on place l'erlenmeyer dans le bain-marie pendant 0,25 heure en agitant. Etape 2 : On retire l'erlenmeyer du bain-marie et on le refroidit légérement sous un filet d'eau du robinet. On enlève le réfrigérant et on ajoute 50 mL d'eau froide. On ajoute 50 mL d'eau glacée et on refroidit l'erlenmeyer dans la glace. On filtre le mélange sur büchner et on rince les cristaux avec de l'eau glacée. On les pèse après séchage et on trouve une masse de 10,68 g. Chromatographie :
corrigé Composé chimique utilisable à la place de l'anhydride éthanoïque : l'acide éthanoïque CH3-COOH Equation bilan : HO-C6H4-COOH + CH3-COOH = CH3-CO-O-C6H4-COOH + H2O Justifions le choix initial : dans le cas de l'acide éthanoïque la réaction est lente, limitée par l'hydrolyse de l'ester. rôle de l'acide sulfurique concentré : catalyseur l'erlenmeyer dit être sec car l'anhydride éthanoïque réagit rapidement avec l'eau pour donner l'acide éthanoïque. Quantités de matière initiales des deux réactifs : anhydride éthanoïque : masse (g) =volume (mL) * densité =m = 15*1,08 = 16,2 g M =4*12+6+3*16=102 g/mol n= m/M= 16,2 / 102 = 0,16 mol acide salycilique : M=7*12+6+3*16 =138 g/mol ; n=m/M = 10 / 138 = 7,2 10-2 mol ( en défaut) Le réactif limitant est l'acide salicylique ; on peut espérer obtenir au plus 7,2 10-2 mol d'ester. masse théorique d'ester :7,2 10-2 M(ester) = 7,2 10-2*180= 13 g. Rendement de la synthèse : masse expérimentale / masse théorique *100 = 10,68 /13*100 = 82%. Nom de l'étape 2 : blocage cinétique Chromatographie : composition de l'aspirine préparée : acide
acéthylsalycique
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|