|
|
||||||||||||||||||||||||||
|
||||||||||||||||||||||||||
|
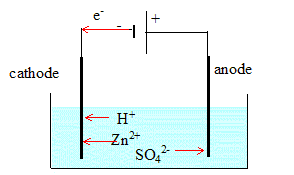
Plus de 50 % de la production mondiale de zinc est obtenu par électrolyse d'une solution de sulfate de zinc, acidifiée à l'acide sulfurique. Les ions sulfates ne participent pas aux réactions électrochimiques.. On observe un dépôt métallique sur une électrode et un dégagement gazeux sur l'autre. I- Etude de la transformation :
II- Exploitation : l'électrolyse a lieu sous 3,5 V. L'intensité du courant peut atteindre 80 kA. Après 48 H de fonctionnement, le dépôt de zinc est suffisamment épais. Il est alors séparé et fondu en lingots.
les réactions susceptibles de se produire sur chaque électrodes : à la cathode négative, réduction : Zn2+ (aq) + 2e- = Zn(s) majoritaire mais aussi 2H+ (aq) + 2e- = H2(g) à l'anode positive, oxydation : H2O (l)= ½O2 (g)+ 2H+ (aq) + 2e-. d'où l'équation globale de cette électrolyse : Zn2+(aq) + H2O(l) = Zn + ½O2(g) + 2 H+(aq) L'électrolyse est une transformation forcée qui nécessite un apport d'énergie électrique. vérification théorique : comparer le quotient initial et la constante d'équilibre .
Zn2+ (aq) + 2e- = Zn(s) d'où : la quantité de matière d'électrons n( e-) est égale à 2 fois la quantité de matière de zinc. n( e-) = 2x Quantité de matière d'électricité Q= 96000 n(e-) =96000*2 x = 1,92 105 x ordre de grandeur de la masse de zinc produite en 2 jours par une cellule : de plus Q= I t = 8 104 * 2*24*3600 = 1,38 1010 C d'où x = 1,38 1010 / 1,92 105 = 7,2 104 mol masse de zinc (g)= masse molaire (g/mol) * Qté de matière (mol) = 65* 7,2 104 =4,68 106 g = 4,68 t. on obtient une quantité de zinc inférieure à celle attendue : les ion H+ se réduisent également à la cathode. relation entre l'avancement x et le volume V de dioxygène récupéré : quantité de matière de O2 (mol) = volume (L) / volume molaire (L/mol) = V/24 = ½ x soit V= 12 x ordre de grandeur de V : 12*7,2 104 = 8,6 105 L = 8,6 102 m3. en tenant compte du rendement : 8,6 102*0,8 = 688 m3.
|
||||||||||||||||||||||||||
|
|