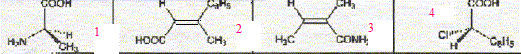|
|
||||
|
|
||||
|
Les réponses sont écrites entre parenthèses ou en rouge.
|
||||
|
|
||||
corrigé 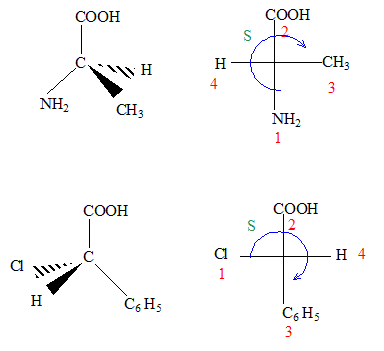
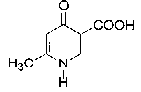
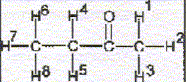
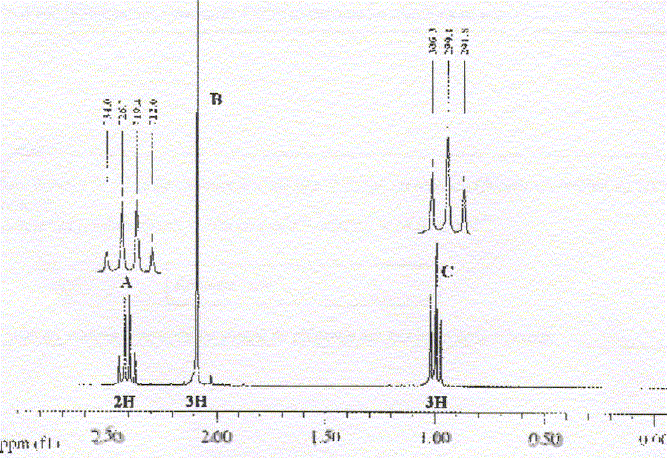
La molécule 2 comporte une double liaison carbone-carbone : l'ordre des priorité des quatre substituants est le suivant COOH > C6H5 > CH3 > H. Les deux groupes prioritaires COOH et C6H5étant situés de part et d'autre de la liaison double, il s'agit de l'isomère E. La molécule 3 comporte une double liaison carbone-carbone : Les deux groupes identiques CH3 étant situés de part et d'autre de la liaison double, il s'agit de l'isomère E. Les protons notés 1, 2, 3 sont identiques et correspondent au singulet situé à 2,1 ppm ( d= 2,1) Les protons notés 4 et 5 corresondent au quadruplet situé vers 2,5 ppm ( d= 2,4 ; J voisin 8 Hz) Les protons notés 6, 7, 8 correspondent au triplet situé à 1 ppm ( d= 1 ; J voisin 8 Hz) CH3-CH2-COCl + CH3-CH2-NH-CH2-CH3 --->CH3-CH2-CO N(CH2-CH3)2 + HCl préparation d'un amide.
|
||||
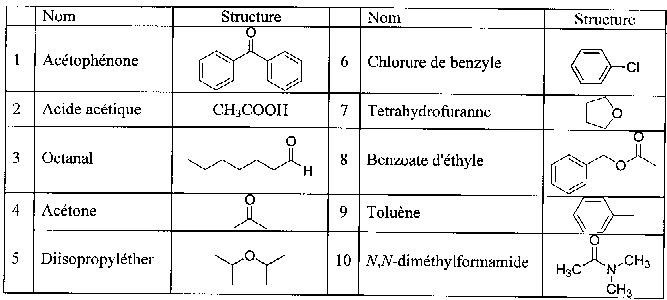
corrigé D'une part une phase apolaire retient d'autant plus un composé qu'il sera apolaire : pentane et 2-méthylbutane plus retenus que le pentan-2-ol ; d'autre part une phase apolaire retiendra les composés dans l'ordre de leur température d'ébullition (le plus volatil sort le premier) ; Enfin, sous une pression donnée, la température d'ébullition d'un alcane à chaîne carbonée ramifiée est plus basse que la température d'ébullition de l' isomère à chaîne carbonée linéaire : d'où l'ordre de
sortie : 2-méthylbutane, pentane, pentan-2-ol.
masse d'acide (g) = masse molaire (g/mol) * quantité de matière (mol) = 458,42*05/0,9 en tenant compte de la pureté de l'acide : m = 458,42*05/(0,9*0,995) =255,96 g. Le chlorure d'acide réagit avec l'eau : RCOCl + H2O = R-COOH + HCl. et avec l'alcool pour former un ester : RCOCl + C6H11 OH = R-COO -C6H11+ HCl. masse de "cyclohexanol " : 20*0,948 = 18,96 g. masse de cyclohexanol pur : 18,96*0,992 =18,8083 g quantité de matière de cyclohexanol : n1 =m1/M( cyclohexanol)= 18,8083 /100,16 = 0,18778 mol masse d'eau : 18,96*0,008 =0,15168 g quantité de matière d'eau : n2 = m2 / M(eau) =0,15168 / 18,02 = 0,00842 mol Quantité de matière
de chlorure d'acide : n1+n2
= 0,18778 +0,00842 =0,196
mol.
proposition A retenue.
|
||||
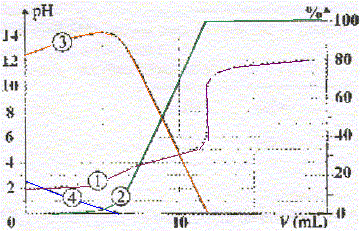
corrigé (1) : courbe d'évolution du pH en fonction du volume de soude ajouté (2) : forme A2- , base du couple AH- / A2- ; (3) : forme AH- , base du couple AH2/ AH- ; (4) : forme AH2. Le second saut de pH permet de déterminer la concentration C de l'acide, le premier saut est à peine visible. A l'équivalence les quantités de matière de réactifs mis en présence sont en proportions stoechiomètriques :VB2 éq = 12 mL Quantité de matière de soude : nB=VB2 éq CB = 12 * 0,050 = 0,6 mmol Quantité de matière d'acide oxalique : nA= V0C = 20 C mmol réaction du titrage : AH2 + 2HO- = A2- + 2H2O. nB= 2nA ;
d'où nA= ½nB= 0,3 mmol et
C=0,3/20 = 0,015 mol/L.
Le pH d'une solution tampon ne varie pas par dilution ; Le pH d'une solution tampon varie peu lors de l'ajout modéré d'un acide ou d'une base forte. à pH = 7,2 = pKa (H2PO4-/ HPO42-), [H2PO4-]=[ HPO42-] équation de la réaction : 2H3PO4 + 3HO- = H2PO4-+ HPO42-+ 3H2O. à partir de 10*0,1 = 1 mmol d'acide phosphorique il faut
ajouter 1,5 mmol de soude à 1 mol/L; soit 1,5
mL.
de plus le produit ionique de l'eau s'écrit : [HO-] [H3O+]= 10-14 à 25 °C d'où : Ks = [Zn2+]10-28 / [H3O+]2 ; [H3O+]2 = [Zn2+]10-28 /Ks. 2log[H3O+] = log [Zn2+]-28 -log Ks ; pH= 14 +½ log Ks -½ log [Zn2+] = 14-8+1 =7.
de plus le produit ionique de l'eau s'écrit : [HO-] [H3O+]= 10-14 à 25 °C d'où : Ks = [Fe3+]10-42 / [H3O+]3 ; [H3O+]3 = [Fe3+]10-42 /Ks. 3log[H3O+]
= log [Fe3+]-42 -log Ks ;
pH= 14 +1/3 log Ks
-1/3 log [Fe3+] = 14-12,67+0,67 =2.
d'une part : Ag+ +Cl- = AgCl(s) (1) d'autre part : Ag+ + 2NH3 = [Ag(NH3)2]+(2) la réaction (2)
consomme l'ion Ag+ restant en solution et en
conséquence l'équilibre (1)
est déplacé vers la gauche, dissolution de AgCl(s) ( loi de Le
Chatelier)
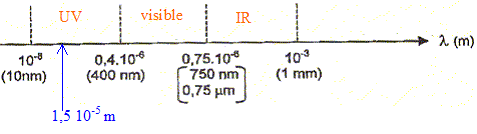
rechercher la longueur d'onde correspondant au maximum d'absorption du composé. Pour cette longueur d'onde, régler le 0 % d'absorbance du spectrophotomètre sur le solvant, l'eau. Faire une gamme de teintes ( solution de concentrations connues) et mesurer pour chaque solution l'absorbance. Tracer la courbe A= f(C) et déterminer le coefficient directeur de la droite.
Lorsqu'une lumière monochromatique d'intensité I0 traverse un milieu homogène, l'intensité de la lumière émergente I décroît exponentiellement lorsque l'épaisseur l du milieu absorbant augmente. I = I0 . e (- al) a est une constante appelée coefficient d'absorption, caractéristique du milieu et de la longueur d'onde considérés. Dans le cas des solutions, la loi de Beer fait intervenir les concentrations. I = I0 . e (- elc) où e est un coefficient caractéristique de la substance appelé coefficient d'absorbance (L mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L). Cette loi est vérifiée lorsque la solution est de concentration inférieure à : c < 0,1 mol.L-1. La relation fondamentale utilisée en spectrophotométrie est présentée sous la forme : A= log (I0/I) = elc ( A est l'absorbance ou densité optique) e est une caractéristique de la molécule. Plus e sera grand, plus la solution absorbe. Absorbance et concentration étant proportionnelles,
cette relation peut être utilisée pour réaliser des dosages ou des
suivis cinétiques.
|
||||
|
|