|
d'après
concours adjoint
technique de recherche et formation, préparateur en chimie
( Bourgogne 2005)
|
|
|
|
|
Nomenclature : réponses écrites en bleu.
- Ecrire les symboles chimiques des éléments suivants :
fluor ( F) ; mercure (
Hg ) ; iode (I) ; cuivre (Cu) ; arsenic ( As) ; nickel (Ni).
- Donner les noms des éléments et des produits
chimiques correspondant aux symboles ou aux formules brutes suivantes :
C6H6 benzène ; Xe : xénon ; Cs : scandium ; Cu(OH)2
: hydroxyde de cuivre II
; W : tungstène ; CH3COOH
: acide éthanoïque ou acétique.
- Ecrire les formules chimiques des composés ou des
ions suivants :
eau oxygénée H2O2
; amonium NH4+
; sulfite SO32-
; butanal : CH3-CH2-CH2-CHO
; sulfate SO42-
; butan-2-one : CH3-CO-CH2-CH3.
- Ecrire l'équilibre acido-basique du couple
hydrogénocarbonate / carbonate.
HCO3-
= H+ + CO32-.
|
|
Analyse qualitative
par voie chimique :
- Caractérisation des halogènes : l'analyse d'un
halogène noté X peut être basée sur la précipitation de l'halogénure
d'argent, produit par l'addition de nitrate d'argent.
- Quelle est la formule du nitrate d'argent ? AgNO3.
- Quelle est la formule de l'halogénure d'argent ? AgX.
- Ecrire la réaction de précipitation entre X-
et le nitrate d'argent : X-
+ Ag+ --> AgX (s).
- En supposant que le produit obtenu soit le chlorure d'argent, quelle
est la couleur du précipité ? blanc
qui noirçit à la lumière.
- Le chlorure d'argent est soluble dans l'ammoniaque. vrai ou faux sans justifier.
- Analyse fonctionnelle : répondre vrai ou faux en
justifiant brièvement.
- Un acide carboxylique tel que l'acide benzoïque ( formule C6H5COOH)
est soluble dans la soude. vrai
La réaction acide base
conduit au benzoate de sodium C6H5COO
- Na+, entièrement ionisé, donc
soluble dans un solvant polaire comme l'eau.
- L'eau et l'éther sont miscibles si la température est supérieure à
37°C. faux
A cette température
l'ether est un gaz, insoluble dans l'eau.
- Les cétones peuvent être caractérisées par la
2,4-dinitrophénylhydrazine. vrai
formation d'une hydrazone,
solide jaune, caractéristique du groupe carbonyle des aldehydes et
cétones.
- L'acidité est un critère suffisant pour caractériser les acides
carboxyliques. faux .
L'acidité ( pH<7 à
25°C ) met en évidence un milieu acide, acide minéral ou acide
carboxylique.
|
|
Préparation
d'une solution
- Vous devez préparer 100 mL d'une solution aqueuse de
sulfate de cuivre II de concentration 0,1 mol/L à partir de CuSO4
pentahydraté.
- Donner la formule brute de CuSO4 pentahydraté
et calculer sa masse molaire ( Cu : 63,5 ; S : 32 ; H : 1 ; O : 16
g/mol)
CuSO4
, 5H2O ; M = 63,5+32+4*16+5*18 = 249,5 g/mol.
- Donner l'expression de la masse de CuSO4
pentahydraté en fonction du nombre de moles et de la masse molaire.
Indiquer les unités.
masse (g) = quantité de
matière (mol) * masse molaire (g/mol).
- Quelle est la masse de CuSO4 pentahydraté
nécessaire pour préparer la solution ?
quantité de matière (mol)
= volume solution (L) * concentration (mol/L) = 0,1*0,1 = 0,01 mol
masse 0,01*249,5 = 2,5 g.
- Faire la liste du matériel et de la verrerie nécessaire pour cette
préparation.
balance de précision,
coupelle de pesée, spatule, bécher, pisette + eau distillée, fiole
jaugée 100 mL, agitateur magnétique.
- Décrire le mode opératoire complet.
pesée de 2,5 g de solide ;
dissoudre dans un bécher conteant de l'eau distilée ; placer dans la
fiole jaugée ; rincer le bécher ; compléter la fiole jaugée jusqu'au
trait de jauge avec de l'eau distillée ; agiter pour rendre homogène.
- Un décapant
contient de l'HCl. On le dilue 100 fois et on dose 10 mL de la solution
diluée par une solution de NaOH de concentration 0,01 mol/L.
L'équivalence est obtenue pour un volume de 13,1 mL ( Cl : 35,5 ; H : 1
g/mol).
- Le décapant est-il très acide ou faiblement acide ? Justifier
brièvement.
Le volume de
la prise ( 10 mL) et le volume de soude à l'équivalence sont voisins,
donc les concentrations de la soude et de l'acide dilué sont proches.
HCl dans le décapant à une concentration proche de 1 mol/L : donc très
acide.
- Quel est l'équation bilan du dosage ? H3O+
+ HO- = 2H2O ou HCl +
NaOH = NaCl +H2O.
- Déterminer la concenration molaire de la solution diluée à
l'équivalence. CaVa
= CbVb soit Ca
= CbVb / Va
=0,01*13,1 / 10 = 0,0131 mol/L.
- En déduire la concentration molaire et massique de l'acide du
décapant.
C= 100*0,0131
= 1,31 mol/L ; masse molaire HCl :M= 36,5 g/mol ;
concentration massique (g/L) = masse molaire (g/mol) * concentration
molaire (mol/L) = 1,31 *36,5 = 47,8 g/L.
- Quelles précautions doit-on prendre pour manipuler le décapant ? port de blouse, gants et lunette de
protections.
- Un étudiant reçoit une projection de décapant sur la main, que
faîtes-vous ? Laver à
grande eau.
- Sur un flacon
d'alcool benzilique, on peut lire l'indication suivante d= 1,04.
- Que représente d ? densité
de cet alcool par rapport à l'eau.
- Quelle est la masse volumique de l'alcool benzilique ? 1,04 g/cm3 ou 1040
kg m-3.
- Le
dihydrogénophosphate de sodium NaH2PO4
possède des propriétés acide et basique en solution aqueuse. Justifier
en écrivant les équations bilan.
H2PO4-
acide du couple H2PO4-
/ HPO42- : H2PO4-
= HPO42- + H+
H2PO4-
base du couple H3PO4 / H2PO4-
: H3PO4 = H2PO42-
+ H+
|
|
Sécurité
- Compléter les phrases suivantes en choisissant une ou
plusieurs réponses :
- Certains composés présentent un risque d'incendie parce qu'il peuvent
être : carburants, volatils,
comburants, ininflammables.
- Les extincteurs doivent être révisés périodiquement.
Quelle est cette périodicité ? tous les 5 ans, annuelle,
semestrielle, trimestrielle.
- Indiquer le principal risque lié au produits suivants
: dérivés du mercure (très
toxique) ; brome (toxique
et irritant), tétrachlorométhane (vapeurs nocives)
; chloronitrobenzène (cancèrogène
pour l'homme).
- Parmi les règles de sécurité concernant les
bouteilles de gaz sous pression décrites ci-dessous, quelles sont
celles à respecter lorsqu'on les manipule ?
- Vider entièrement la bouteille.
- La bouteille doit être
fixée solidement au mur.
- Pour déplacer la
bouteille, utiliser un diable.
- Graisser le détendeur d'un bouteille d'oxygène.
- Répondre par vrai ou faux sans justifier :
- L'eau de Javel libère du chlore en milieu acide. vrai.
- Les solvants chlorés ne doivent pas être mis en présence d'une base. vrai (Le
trichloréthylène réagit avec la soude suffisamment concentrée en
donnant du dichloracétylène, gaz instable, toxique, inflammable
)
- Le contact entre de l'acide nitrique concentré et la propanone est
explosif. vrai
- Les peroxydes organiques sont stables. faux.
- L'acide perchlorique peut être stocké avec des composés organiques. faux.
- Les métaux alcalins ( lithium, sodium, potassium ) réagissent
violemment avec les composés organiques chlorés ( CHCl3,
CCl4).vrai
- Le point
d'éclair rend compte de l'inflammabilité d'un composé. vrai
- L'acide propanoïque a une odeur désagréable. vrai
|
|
Réactions
chimiques
- Compléter les réactions chimiques en donnant les
formules de A, B, C et D. Retrouvez le nom de chaque réaction parmi la
liste suivante : substitution, addition, hydratatation, et
estérification.
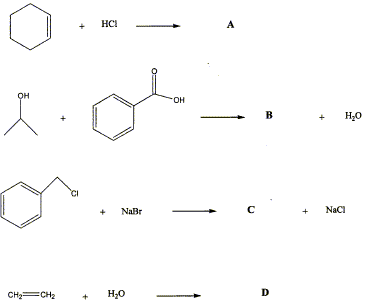
- Equilibrer la réaction de combustion suivante : C2H2+2,5O2
--> 2CO2
+ H2O
|
|
Techniques
analytiques
- Citez le nom des
techniques analytiques suivantes :
- Opération qui consiste à séparer les particules solides qui se
trouvent dans un liquide : décantation.
- Procédé permettant la séparation de deux liquides non miscibles de
densités différentes : extractionpar
solvants.
- Méthode de séparation des constituants d'un mélange liquide homogène
: chromatographie.
- Technique de la
recristallisation :
- A quoi sert une recristallisation ? purification.
- Sur quel principe est-elle basée ? différence de solubilité, à chaud
et à froid ,dans les solvants du corps à purifier et des impuretés.
- Quelles sont les différentes étapes d'une recristalisation ?
Choix
du solvant : le solide à purifier ne doit pas réagir avec le
solvant ; la solubilité du produit à purifier doit être élevée dans le
solvant chaud et faible dans le solvant froid ; les impuretés
organiques doivent être solubles dans le solvant à froid.
Dissoudre le solide (impur) à chaud dans le minimum de solvant.
Laisser refroidir ( les cristaux se forment)
Filtration sous pression réduite et séchage.
- Le point de fusion des cristaux purifiés est-il plus élevé ou moins
élevé que celui du solide de départ ? plus élevé. La température de début de
fusion des cristaux impurs est inférieure à la température de fusion du
produit pur.
|
|
Electricité
:
- Quelle relation relie la tension à la résistance
électrique et l'intensité. Indiquer les unités. Quel nom porte cette
relation ?
Loi d'Ohm pour un résistor :
U(V) = R(W) I (A).
- En électricité, quel symbole utilise-t-on pour désigner une pile, la
terre, un fusible, la masse, un courant alternatif , un condensateur ?
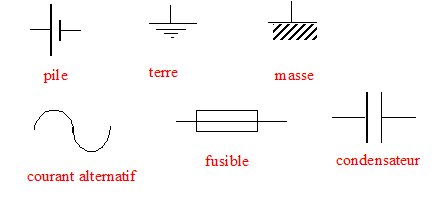
|
|
retour
-menu
|

