|
|
||||
|
||||
|
L'étiquette d'une solution commerciale d'acide nitrique HNO3 indique : masse molaire M= 63 g/mol ; densité d = 1,40 ; pourcentage massique en acide nitrique 65 %.
corrigé masse de 1 L de solution : 1,4 kg = 1400 g masse d'acide pur dans 1 L de solution : 1400*0,65 =910 g Quantité de matière d'acide (mol) = masse (g) / masse molaire (g/mol) = 910 / 63 = 14,44 mol concentration moalire en acide nitrique de cette
solution commerciale : 14 mol L-1. ( deux chiffres significatifs)
facteur de dilution F = concentration mère / concentration fille = 14,44 / 1 = 14,44 volume de la solution fille (mL) / volume de la prise de solution mère (mL) = 14,44 volume de solution mère à prélever : 250 / 14,44 = 17,3 mL ( 17 mL)
|
||||
|
En fin d'année, vous devez épuiser les crédits de votre laboratoire. Pour cela vous décider de commander du petit matériel de laboratoire. Vous disposez de 1480,80 euros TTC de crédits. Le fournisseur vous adresse un devis hors taxe d'un montant de 1391,07 euros. De combien doit être la remise (en % ) que le fournisseur voudra bien vous consentir sur le montant hors taxe pour que vous puissiez dépenser au mieux l'intégralité de vos crédits. Le taux de TVA est de 19,6 %. corrigé prix TTC maxi : 1480,80 euros pris maxi HT : 1480,80/(1+0,196) =1238,13 euros montant de la remise : 1391,07-1238,13=152,94 euros soit : 152,94*100/ 1391,07 = 11 %. |
||||

corrigé A: acide éthanoïque ou acétique ; B : éthanol ; C : acétate d'éthyle ; D : eau estérification, lente, limitée par l'hydrolyse de l'ester, athermique. quantité théorique de produit C : M acide = 60 g/mol ; M alcool = 46 g/mol ; Mester = 88 g/mol nacide = m/Macide = 6,0/60 = 0,10 mol ; nalcool = m/Malcool = 6,9/46 = 0,15 mol ( en excès) on peut obtenir au plus 0,1 mol d'ester soit 88*0,1 = 8,8 g. rendement de la réaction : masse réelle / masse théorique * 100 = 67 %.
|
||||
|
Vous disposez d'une solution de HCl de concentration 10 mol/L. Vous souhaitez préparer par dilution 100 mL d'une solution à 1 mol/L. Décrivez avec précision le matériel utilisé ainsi que les différentes étapes de cette préparation. Indiquez les précautions à prendre. corrigé facteur de dilution F = concentration mère / concentration fille = 10 / 1 = 10 volume de la solution fille (mL) / volume de la prise de solution mère (mL) = 10 volume de solution mère à prélever : 100 / 10 = 10 mL. Prélever à la pipette jaugée + pipeteur 10 mL de solution à 10 mol/L Placer dans une fiole jaugée de 100 mL contenant un peu d'eau distillée. Compléter jusqu'au trait de jauge avec de l'eau distillée. agiter pour rendre homogène. La solution à 10 mol/L étant corrosive, port de blouse, lunette et gants de protection ; travail sous hotte.
|
||||
|
Un préparateur a oublié de coller les étiquettes sur les solutions qu'il vient de préparer. Il s'agit de solutions à 0,1 mol/L d'acide sulfurique H2SO4, d'hydroxyde de potassium KOH, de chlorure de sodium NaCl, d'acide acétique CH3-COOH. Il décide de mesurer le pH de chaque solution ; il trouve : 7 ; 12,8 ; 4,1 ; 0,7. En justifiant affecter la valeur du pH à chaque solution. corrigé La solution de chlorure de sodium est neutre : pH= 7 à 25°C La solution d'hydroxyde de potassium est basique : pH=12,8. L'acide acétique étant un acide faible, le pH est supérieur à -log C avec C= 0,1 mol/L : d'où 4,1. La solution d'acide sulfurique ( diacide fort ) a un pH de 0,7.
|
||||
|
On souhaite préparer une solution de sulfate de cuivre CuSO4. Pour cela on utilise le sulfate de cuivre pentahydraté en poudre CuSO4, 5 H2O. Quelle masse de ce produit faudra-t-il peser pour obtenir 200 mL de solution de concentration en ion Cu2+ égale à 0,40 mol/L ? Cu : 63,55 ; S : 32,06 ; O : 15,99 ; H : 1,00 g/mol. corrigé M : Masse molaire de CuSO4, 5 H2O ; M= 63,55 + 32,06+4*15,99 + 5(2+15,99)=249,52 g/mol CuSO4 (s) donne par dissolution Cu2+(aq) + SO42-(aq) la concentration effective de chaque ion est égale à la concentration en soluté apporté. Quantité de matière de sulfate de cuivre dans 200 mL de solution à 0,4 mol/L : concentration (mol/L) * volume (L) = 0,4*0,2 = 0,080 mol masse de solide (g) = quantité de matière (mol) * masse molaire (g/mol) = 0,080*249,52 = 19,96 g ( 20 g) ( 2 chiffres significatifs)
|
||||
|
On donne la notation AZX. Que représentent A, Z et X ? corrigé X : symbole de l'élément chimique Z : numéro atomique ou nombre de charge, ou nombre de protons A : nombre de nucléons = nombre de protons + nombre de neutrons.
|
||||
|
|
||||
|
On plonge de la limaille de fer Fe, dans une solution de sulfate de cuivre.
corrigé La solution initiale de sulfate de cuivre est de couleur bleue. Le fer est le réducteur le plus fort , il s'oxyde suivant : Fe = Fe2+ + 2e- ; réaction d'oxydation. L'ion cuivre II est l'oxydant le plus fort, il se réduit suivant : Cu2++ 2e- = Cu ; réaction de réduction. La réaction mettant en jeu simultanément fe fer et les ions cuivre II est une oxydo-réduction Cu2++Fe = Fe2+ +Cu Le dépôt de cuivre est de couleur rouge. Si la limaille de fer est en excès, tous les ions cuivre II disparaissent et la solution finale est incolore.
|
||||
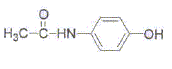 Lors de la synthèse, on obtient 2,40 g de paracétamol à patir de 0,035 mol d'anhydride acétique et 0,025 mol de paraaminophénol.
corrigé NH2-C6H4-OH + [CH3-CO]2O = 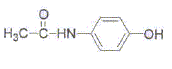 + CH3-COOH + CH3-COOH
puis l'acide acétique peut réagir sur la fonction amine. CH3-COOH + NH2-C6H4-OH = CH3-COO- + +NH3-C6H4-OH ( réaction limitée) Bilan : 2NH2-C6H4-OH
+ [CH3-CO]2O = Masse molaire paracétamol C8H9O2N : M= 8*12+9+32+14=151 g/mol quantité de matière paracétamol : masse (g) / masse molaire (g/mol) = 2,40 / 151 = 0,016 mol. Or d'après les coefficients stoéchiométriques, 0,016 mol de paracétamol est obtenu à partir de 0,016 mol d'anhydride acétique. On en a mis 0,035 mol. L'anhydride acétique est en excès.
|
||||
|
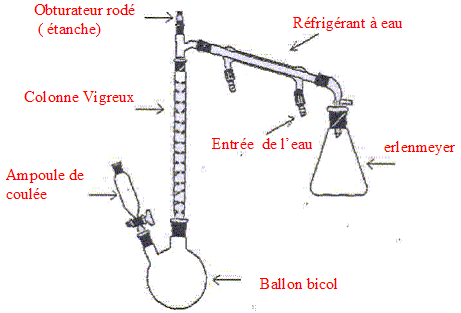
Nommer les différents éléments du montage. 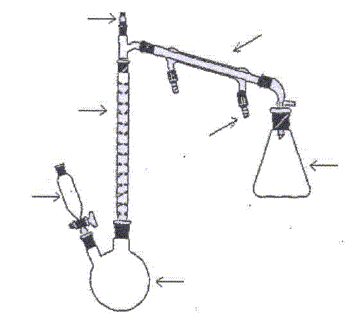
|
||||
 Donner la signification des pictogrammes. corrigé A: irritant ou nocif ; B : Toxique ou très toxique ; C : dangers pour l'environnement ; D : radioactivité ; E : risque biologique F : risque d'explosions ; G : matières inflammables ; H : matières corrosives ; I : danger électrique ; J : radiations non ionisantes K : risque d'asphixie; L : douche de sécurité ; M : défense de fumer ; O : protection obligatoire de la vue ; P : sortie et issue de secours
|
||||
|
corrigé pictogrammes : très toxique, dangers pour l'environnement risques : R21 : Nocif par contact avec la peau R25-26 : Toxique en cas d'ingestion, tès toxique par inhalation R37 : irritant pour les voies respiratoires R38 : irritant pour la peau R41 : Risque de lésions oculaires graves R49 : Peut causer le cancer par inhalation Sécurité : S45 : En cas d'accident ou de malaise consulter immédiatement un médecin S53 : Eviter l'exposition S60 : Eliminer le produit et le récipient comme un déchet dangereux Produit chimique inconnu : Les catalogues des fournisseurs indiquent les risques (les pictogrammes et phrases de risques R) recherche à l'aide d'un moteur de recherche " nom produit + sécurité " Pour les besoins d'un enseignement de TP, vous re-conditionnez un produit chimique liquide livré dans une bonbonne de 2,5 L en flacons de 250 mL. Sur l'étiquette de chaque flacon, indiquer le nom du produit, et coller les pictogrammes de risques.
|
||||
|
Quel moyen d'extinction faut-il choisir dans les cas suivants ?
|
||||
|
Indiquer dans quel armoire de stockage vous rangez les produits chimiques suivants ?
|
||||
|
|