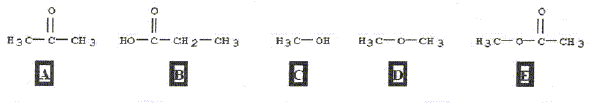|
d'après
concours adjoint
technique de recherche et formation, préparateur en chimie
( sciences chimiques et sciences des matériaux
Lille 2004)
|
|
|
|
|
Identification : réponses écrites en bleu.
- L'hypochlorite de sodium est utilisé dans la vie
courante, pour quel usage ? détergent, désinfectant,
eau permutée, autre.
- Quel est son nom usuel ? eau
de Javel.
- Le symbol Ab-
correspond à un cation , un
anion ?
- Identifier les fonctions présentes dans les composés
ci-dessous :
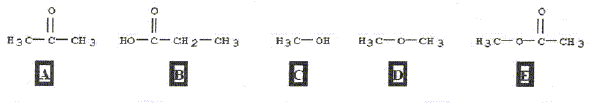
A : cétone ; B : acide
carboxylique ; C : alcool ; D : éther ; E : ester.
- Quel est le nom d'usage des composés chimiques
suivants : HCl acide chlorhydrique, NaOH soude, CaCO3
calcaire
?
- Quels sont les symboles des éléments suivants ? azote
N, magnésium Mg, fluor F, sodium Na.
|
|
pH :
- Donner la définition et la formule gégérale du pH. ( potentiel hydrogène )
Le pH se calcule à partir de la relation pH= - log [H3O+]
avec [H3O+] exprimée en
mol/L.
- Classer par ordre de pH croissant les solutions
aqueuses suivantes : hydroxyde de sodium, acide chlorhydrique, sulfate
de sodium.
acide chlorhydrique,
sulfate de sodium, hydroxyde de sodium.
- Un chimiste a préparé les solutions suivantes, toutes
à la même concentration, mais a oublié de coller les étiquettes sur les
flacons. A : NaOH ; B : NaCl ; C : HNO3 ; D : CH3COOH.
Il rattrape son erreur, en mesurant le pH de chaque solution. Les
valeurs suivantes sont obtenues :2 ; 3,4 ; 7 et 12. Attribuer chaque
valeur à la solution correspondante en justifiant.
NaCl : pH=7 solution
neutre ; HNO3 : pH=2, acide fort, entiérement
dissocié ; CH3COOH pH= 3,4, acide faible ; NaOH
: pH=12, base forte.
- Qu'est-ce qu'une solution tampon ? une solution qui
ne s'oxyde pas ; un mélange équimolaire de base et d'acide ; une solution dont le pH reste constant.
- A 100 mL d'une solution tampon phosphaté pH=7,2 on
ajoute 20 mL d'eau distillée. Quel est le pH de cette nouvelle solution
? Justifier.
pH=7,2, le
pH d'une solution tampon ne varie pas par dilution, les concentrations
de la base faible et de son acide conjuguée variant de la même manière.
- Quel est le pH de la solution suivante : 20 mL d'HCl
à 0,2 mol/L et 20 mL NaOH à 0,2 mol/L ? Justifier.
pH=7, réaction acide fort
base forte : les réactifs sont en proportions stoechiométriques ; on se
trouve donc à l'équivalence.
- Donner la formule de l'acide chlorhydrique. HCl.
- Le pH d'une solution d'acide chlorhydrique à 10-3
mol/L est égal à : 1, 3 , 7, 9, 11. acide
fort donc pH= -log 10-3 = 3.
- Convertir : 15,1 mg = 15,1
10-3 g = 0,0151 g.
7,5 g = 7,5 10-6
mg ; 10 cm3
= 10 10-3 mL = 10-2 m L.
|
|
Préparation
solution
- Dans un catalogue
de produits chimiques, les informations suivantes sont relevées :

- Quelle est la
concentration molaire de cette solution commerciale ?
masse de 1L :
1,23 kg = 1230 g ; masse d'acide pur dans 1 L : 1230*0,5 = 615 g
quantité de matière (mol) dans 1 L = masse (g) / masse molaire (g/mol)
= 615 / 66 = 9,3 mol dans 1L.
- Que signifie le pictogramme C ? corrosif.
- La masse molaire
de NaCl est 58,5 g/mol. Quelle masse doit-on peser pour préparer 2 L de
solution à 0,5 mol/L ?
quantité de
matière (mol) = volume (L) * concentration (mol/L) = 2*0,5 = 1 mol soit
58,5 g à peser.
- On veut préparer 1
L de solution 10-2 mol/L de Ni2+.
Le sel utilisé est le sukfate de nickel hexahydraté ( NiSO4,
6 H2O ) de pureté 97%. Calculer la masse
molaire.( Ni : 58,7 ; S : 32,1 ; O : 16 ; H : 1 g/mol)
M= 58,7 +
32,1+4*16+6*18 =262,8 g/mol.
- Combien faut-il peser de ce produit ?
Quantité de
matière dans 1 L : 0,01 mol
masse (g) = quantité de matière (mol) * masse molaire (g/mol) =
0,01*262,8 = 2,628 g
en tenant compte de la pureté : 2,638 / 0,97 = 2,71 g.
- Parmi la verrerie ci-dessous, laquelle faut-il choisir pour préparer
cette solution?
bécher de 1L, entonnoir de 20 cm de diamètre, büchner, éprouvette
graduée de 1L, pipette 10 mL, flacon gradué de 1L, bécher de 50 mL, entonnoir de 6 cm de diamètre, erlemeyer de 1L, burette graduée de 50 mL,
fiole
jaugée de 1L.
- A partir de la solution précédente on veut préparer 250 mL de
solution à 2 10-4 mol/L. Quel est le facteur de
dilution F ?
F =
concentration mère / concentration fille = 0,01 / 2 10-4
=50.
Combien faut-il prélever de solution ? F= volume fiole jaugée / volume pipette ;
volume pipette = volume fiole jaugée / F = 250 / 50 = 5 mL.
Parmi la verrerie suivante laquelle choisir ? erlenmeyer de 250 mL,
pipette graduée de 10 mL, micropipette de 1 mL, bêcher de 50 mL,
éprouvette graduée de 10 mL, une burette graduée de 50 mL, un flacon de
250 mL, une pipette
jaugée de 5 mL, une fiole jaugée de 250 mL.
- Une réaction
exothermique : dégage
de la chaleur ;
consomme de la chaleur.
|
|
Equation
bilan
Equilibrer les
équations bilan des réactions chimiques suivantes :
3Fe +2 O2 --> Fe3O4.
2S2O32-
+ I2 --->S4O62-
+2I-.
5Fe2+ + MnO4-
+ 8H3O+
---> 5Fe3+ + Mn2+
+12 H2O
C6H12
+ 9 O2 -->6
CO2 + 6 H2O
|
|
Méthodes
séparation
Parmi les méthodes suivantes : filtration,
distillation, tamisage, évaporation, centrifugation, décantation,
quelle(s) est (sont) celle(s) qui permet (ent) de séparer ?
- un solide d'un liquide (filtration,
décantation) ; des solides de tailles différentes (tamisage) ; différents liquides
miscibles (distillation)
Physique :
- La tension aux bornes d'une résistance de 4 ohms est
de 9 V. Calculer l'intensité du courant qui la traverse.
I= U/R = 9/4 = 2,25A.
- Le disjoncteur d'un atelier porte les indications
suivantes : 220 V ; 80 A . Quelle est la puissance disponible ?
P( W) = U( V) * I(A) =
220*80 = 17600 W= 17,6 kW.
- Quelle énergie électrique en kWh consomme une machine de 750 W qui
fonctionne pendant 1 heure ?
énergie (kWh) = puissance
(kW) * durée (heure) = 0,75*1 = 0,75 kWh.
- Peut-on faire fonctionner simultanément 25 de ces machines avec les
caractéristiques du disjoncteur précédent ?
Puissance consommée par
les 25 machines : 0,75*25 = 18,75 kWh ; la puissance disponible est
dépassée, le disjoncteur va couper le courant si les 25 machines
fonctionnent simultanément.
- Donner le nom et le type de grandeur des symboles suivants :
V : tension en volt ; Pa : pression en pascal ; W :
puissance en watt ; W : résistance
en ohm.
- Que peut-on mesurer avec les appareils suivants ? Ampèremètre ( intensité du courant) ;
Manomètre ( pression )
Mathématiques
:
- Vous commandez, auprès d'un laboratoire spécialisé,
pour 3200 euros ( TTC) de produits chimiques. Une remise de 10 % a été
consentie par le fournisseur sur le montant HT de ces produits. Quel
est le coût HT de ces produits avant remise ( TVA à 19,6 %)
Prix HT : 3200 / 1,196 =
2675,6 euros
Prix HT avant remise de 10 % : 2675,6 / 0,9 = 2972,9 euros.
- Vous êtes chargé du suivi des stocks du laboratoire.
Compléter la fiche ci-dessous sachant que :
Vous disposez de 100 lots au 1/10/03 ; au cours de la semaine n°1, 24
lots sont utilisés ; au cours de la semaine n°2, vous commandez 50 lots
; au cours de la semaine n°3, 17 lots sont utilisés, 40 lots sont
livrés ; au cours de la semaine n°4, 11 lots sont utilisés, 6 sont
livrés.
|
type de produit
|
stock au 1/10/03
|
commande
|
entrée
|
sortie
|
stock au 1/11/03
|
livraison en attente
|
|
lots de flacons
|
100
|
50
|
46
|
52
|
94
|
4
|
- Combien de lots devez vos commander au 1/11 /03 pour conserver le
même stock qu'au 1/10/03 ? 2.
|
|
Sécurité
- Parmi les
consignes générales de sécurité au laboratoire, quelles sont les
consignes qui sont obligatoires en manipulant de l'acide ?
Porter
une blouse en coton
; avoir les cheveux attachés ; mettre
des gants ; mettre des lunettes de protection ; mettre un masque ; travailler sous hotte ; avoir un extincteur à proximité ;
travailler dans une boîte à gants.
- Donner la
sigification des pictogrammes suivants :

A : nocif,
irritant ; B : toxyque ; C : danger pour l'environnement ; D : corrosif
; E : risque biologique ;
F : risque d'explosions ; G : matières inflammables ; H : matières
radioactives ; I : danger électrique ; J : radiations non ionisantes.
- Lorsque vous
préparez une solution d'acide sulfurique à partir d'acide à 97%, il
faut : ajouter
l'acide dans l'eau
; ajouter l'eau dans l'acide ; l'ordre n'a pas d'importance.
- Quel est le
premier geste à faire en cas de projection importante d'acide concentré
sur le corps ? essuyer ; appeler les pompiers ; passer sous la douche ; rincer avec une solution de soude ; se
déhabiller.
- Vous disosez de 4
conteneurs pour récupérer les produits chimiques liquides : un pour les
acides; un pour les bases ; un pour les solvants organiques halogénés ;
un pour les solvants organiques non halogénés ; autre. Où jetez vous le
reste d'une slution de chlorure de sodium à 5 % ? Justifier.
La solution
de salée ( NaCl à 5 %) n'est pas toxique : autres ou évier.
- En salle de TP
vous découvrz une personne inanimée sur le sol, un appareil électrique
encore branché, à la main. Que faîtes vous en premier lieu ?
- Vous essayez de relever la personne en la prenant par les bras. -
Vous la signalez à l'enseignant ; - vous coupez l'alimentation
électrique ;
- vous appelez les pompiers ; - vous essayez de lui retirer l'appareil
électrique des mains.
- Les feux sont
classés en cinq classes : A : feux de solides ; B : feux
de liquides ; C : feux de gaz ; D : feux de métaux. On y ajoute les
feux d'origine électrique E. Dans
quelle classe mettre les feux suivants :
papier filtre ( A) ; sodium( D)
; plastiques ( A) ; tétrachlorure de carbone ( B)
; chauffe ballon( E) ; butane ( C).
- Citez les
différentes voies de pénétrations des substances dangereuses.
Les trois
voies de pénétration d'une substance dangereuse dans l'organisme sont :
contact cutané (port de gants appropriés), ingestion (rare sauf
accident), inhalation (travail sous hotte aspirante).
|
|
retour
-menu
|