|
|
- Chaque atome est représenté par un symbole
AZX.
Que représente X, Z, A ?
X : symbole de l'élément
chimique ; Z : numéro atomique ou nombre de charge ; A : nombre de
nucléons = nombre de protons + nombre de neutrons.
- Une molécule est représentée par une formule brute AaBb.
Que représentent A, a, B, b ?
A et B symboles des atomes
constituants la molécule ; a : nombre d'atome A ; b : nombre d'atome B.
- Donner la formule semi-développée de l'éther
éthylique. CH3-CH2-O-CH2-CH3.
- Donner la formule semi-développée de l'acétone.
Quelle est son nom dans la nomenclature officielle ? CH3-CO-CH3
propanone.
- Ecrire la formule brute et calculer la masse molaire
de la molécule dont la formule développée est :
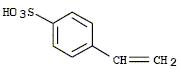
C : 12 ; O : 16 ; H : 1 ; S : 32 g/mol. Formule
brute : C8H8O3S
; M= 8*12+8+3*16+32=184 g/mol.
- Le symbol Ab-
correspond à un cation , un
anion ?
Que représentent A et b ? A :
symbole de l'élément chimique ; b : charge de l'ion ( nombre
d'électrons gagnés par l'atome A).
- Identifier les fonctions présentes dans les composés
ci-dessous :Identifier les fonctions présentes dans les composés
ci-dessous :

- A : cétone ; B :
acide carboxylique ; C : alcool ; D : éther ; E : ester.
- Définir la concentration volumique d'une solution
aqueuse.
Concentration molaire
volumique : Quantité de matière n (mol) de soluté dissout dans le
volume V(L) de solvant. C (mol/L)= n/V
Concentration massique (g/L) = masse de soluté (g) / volume du solvant
(L) .
- En quelles unités peut-elle s'exprimer ? mol
L-1 ; g L-1
; mol kg-1 ; L kg-1 ; g kg-1
; ppm.
- Le titre d'une solution d'alcool s'exprime en degrés.
Quelle est la quantité d'éthanol absolu contenu dans 1 L d'alcool à 95°
? 95 mL, 950 mL, 95 g, 950 g.
Degré alcoolique : volume
( mL )d'alcool pur contenu dans 100 mL de solution : donc 950 mL.
- Pour préparer une solution aqueuse de soude à 20% on
pèse 200 g de soude en pastilles puis on ajoute : 800 g d'eau ; 100 g
d'eau ; 800 mL d'eau ; 1 L d'eau.
La masse de soude doit
représenter 20 % de la masse, notée m, de la solution ; donc m = 1000 g
et la masse du solvant, l'eau, est 800 g.
- On veut préparer 1 L de mélange dioxanne-éthanol à 30
% en volume de dioxanne. Quelles sont les quantités de produits purs à
mélanger ?
- 700 g d'éthanol et 300 g de dioxanne.
- 700 mL d'éthanol et 300 mL de
dioxanne.
- 700 mL d'éthanol et ajuster au litre avec le dioxanne.
- 300 mg de dioxanne et 0,700 L d'éthanol.
- Définir la masse volumique.
masse du corps (g) divisée
par le volume de ce corps ( cm3) . Masse d'un
volume égal à l'unité.
- En quelles unités peut-elle s'exprimer ? mol L-1
; g cm-3
; mol kg-1 ; sans unité ; g ; g kg-1.
- Définir la densité d'un liquide.
Masse d'un certain volume
V du liquide divisée par la masse du même volume d'eau.
- En quelles unités peut-elle s'exprimer ? mol L-1
; g cm-3
; mol kg-1 ; sans
unité ; g ; g kg-1.
- Dans l'expérience ci-contre, quel est le liquide le
plus dense ?
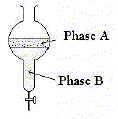
La phase B, la plus dense,
occupe la partie inférieure.
- Une raction exothermique dégage
de la chaleur ; consomme de la chaleur.
- Quels sont les symboles des éléments suivants ? azote
(N) ; magnésium ( Mg) ; soufre ( S) ; phosphore ( P) ; carbone (C) ; sodium ( Na) ; fluor ( F) ; potassium ( K) ; or ( Au) ; calcium ( Ca).
- Donner la formule du pH d'une solution aqueuse. pH= -log[H3O+]
avec [H3O+] exprimée en
mol/L.
- Classer par ordre de pH croissant les solutions
aqueuses suivantes : hydroxyde de sodium, acide chlorhydrique, sulfate
de sodium.
acide chlorhydrique,
sulfate de sodium, hydroxyde de sodium.
- Qu'est-ce qu'une solution tampon ? une solution qui
ne s'oxyde pas ; un mélange équimolaire de base et d'acide ; une solution dont le pH reste constant.
- Donner la formule de l'acide chlorhydrique. HCl.
- Le pH d'une solution d'acide chlorhydrique à 10-3
mol/L est égal à : 1, 3 , 7, 9, 11. acide
fort donc pH= -log 10-3 = 3.
- Ecrire la réaction d'un acide organique sur un
alcool. Quel est le nom de cette réaction ?
R-COOH + R'-OH = R-COO-R'
+ H2O ; estérification.
- L'octane est un hydrocarbure saturé en C8
présent dans l'essence. Donner sa formule brute et écrire la réaction
de combustion complète avec le dioxygène de l'air.
C8H18
+ 12,5 O2 ---> 8 CO2
+ 9 H2O.
|
|
Préparer une solution
:
On veut préparer 1 L
de solution 10-2 mol/L de Ni2+.
Le sel utilisé est le sukfate de nickel hexahydraté ( NiSO4,
6 H2O ) de pureté 97%. Calculer la masse
molaire.( Ni : 58,7 ; S : 32,1 ; O : 16 ; H : 1 g/mol)
M= 58,7 +
32,1+4*16+6*18 =262,8 g/mol.
- Combien faut-il peser de ce produit ?
Quantité de
matière dans 1 L : 0,01 mol
masse (g) = quantité de matière (mol) * masse molaire (g/mol) =
0,01*262,8 = 2,628 g
en tenant compte de la pureté : 2,638 / 0,97 = 2,71 g.
- Parmi la verrerie ci-dessous, laquelle faut-il choisir pour préparer
cette solution?
bécher de 1L, entonnoir de 20 cm de diamètre, büchner, éprouvette
graduée de 1L, pipette 10 mL, flacon gradué de 1L, bécher de 50 mL, entonnoir de 6 cm de diamètre, erlemeyer de 1L, burette graduée de 50 mL,
fiole
jaugée de 1L.
- A partir de la solution précédente on veut préparer 250 mL de
solution à 2 10-4 mol/L. Quel est le facteur de
dilution F ?
F = concentration
mère / concentration fille = 0,01 / 2 10-4 =50.
Combien faut-il prélever de solution ? F= volume fiole jaugée / volume pipette ;
volume pipette = volume fiole jaugée / F = 250 / 50 = 5 mL.
Parmi la verrerie suivante laquelle choisir ? erlenmeyer de 250 mL,
pipette graduée de 10 mL, micropipette de 1 mL, bêcher de 50 mL,
éprouvette graduée de 10 mL, une burette graduée de 50 mL, un flacon de
250 mL, une pipette
jaugée de 5 mL, une fiole jaugée de 250 mL.
|
|
Techniques
de laboratoire
- Définir les différentes parties repèrées sur la
propipette :
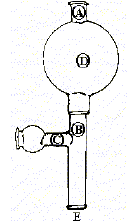
Emplacement pour la pipette ( E)
; presser pour vider la poire (D)
; presser pour aspirer le liquide dans la pipette (B) ; presser pour vider le
liquide de la pipette ( C).
- Parmi les méthodes suivantes : filtration,
distillation, tamisage, évaporation, centrifugation, décantation,
quelle(s) est (sont) celle(s) qui permet (ent) de séparer ?
- un solide d'un liquide (filtration,
décantation) ; des solides de tailles différentes (tamisage) ; différents liquides
miscibles (distillation)
- Vous avez réalisé une filtration sous pression
réduite avec un büchner, un filtre papier, une fiole à vide et une
trompe à eau. Quelle est la première opération à effectuer pour
récupérer en fin d'analyse le solide et le filtrat ?
- Fermer le robinet d'eau ; retirer le büchner ; vider la fiole ;
enlever le filtre ; casser
le vide dans la fiole.
- L'extraction liquide-liquide sert à : obtenir un
liquide pur ; faire passer une
molécule d'un solvant dans un autre.
Pour faire cette extraction vous devez utiliser : un ballon ; une fiole
jaugée ; une ampoule à
décanter ; un flacon.
- Quel est le principal intérêt d'une distillation sous
vide comparée à une distillation classique ?
- Les produits obtenus sont plus purs ; l'opération est plus rapide ; la température nécessaire à la
vaporisation est plus faible.
- Classer dans l'ordre les opérations à effectuer pour arrêter une
distillation sous vide : on arrête le chauffage ; on casse le vide ; on
laisse refroidir le bouilleur.
On arrête le chauffage ;
on laisse refroidir le bouilleur ; on casse le vide.
- Quel est le montage correct pour faire une synthèse
par chauffage à reflux ?
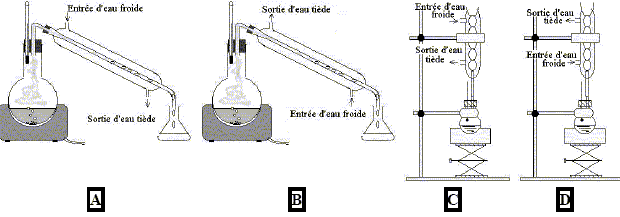
montage D : réfrigérant
droit et arrivée de l'eau en partie basse.
- Pour les opérations suivantes la température doit
être de /
- Stérilisation : 120°C
; 100 °C ; 20 °C ; 60 °C.
- Incubation : 37°C ;
100°C ;-50°C.
- Conservation des produits biologiques :20°C ; 37°C ; <= 0°C.
- Pour préparer un milieu stérile vous utiliser de l'eau déminéralisée,
de l'eau distilée ?
|
|
sécurité
- Parmi les
consignes générales de sécurité au laboratoire, quelles sont les deux
consignes qui sont obligatoires en toutes circonstances ?
Porter
une blouse en coton
; avoir les cheveux attachés ; mettre des gants ; mettre des lunettes de protection ; mettre un masque ; travailler sous hotte
; avoir un extincteur à proximité ; travailler dans une boîte à gants.
- Donner la
sigification des pictogrammes suivants :
-

A : nocif,
irritant ; B : toxyque ; C : danger pour l'environnement ; D : corrosif
; E : risque biologique ;
F : risque d'explosions ; G : matières inflammables ; H : matières
radioactives ; I : danger électrique ; J : radiations non ionisantes.
- Lorsque vous
préparez une solution d'acide sulfurique à partir d'acide à 97%, il
faut : ajouter
l'acide dans l'eau
; ajouter l'eau dans l'acide ; l'ordre n'a pas d'importance.
- Quel est le
premier geste à faire en cas de projection importante d'acide concentré
sur le corps ? essuyer ; appeler les pompiers ; passer sous la douche ; rincer avec une solution de soude ; se
déhabiller.
- Vous disosez de 4
conteneurs pour récupérer les produits chimiques liquides : un pour les
acides; un pour les bases ; un pour les solvants organiques halogénés ;
un pour les solvants organiques non halogénés ; autre. Où jetez vous le
reste d'une slution de chlorure de sodium à 5 % ? Justifier.
La solution
de salée ( NaCl à 5 %) n'est pas toxique : autres ou évier.
- Les pictogrammes
suivants vous indiquent la proximité de :
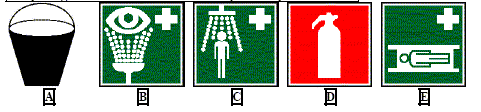
A : seau de sable ; B : rincage
des yeux ; C : douche de sécurité ; D : extincteur ; E : civière.
- En salle de TP
vous découvrez une personne inanimée sur le sol, un appareil électrique
encore branché, à la main. Que faîtes vous en premier lieu ?
- Vous essayez de relever la personne en la prenant par les bras. -
Vous la signalez à l'enseignant ; - vous coupez l'alimentation
électrique ;
- vous appelez les pompiers ; - vous essayez de lui retirer l'appareil
électrique des mains.
- Les feux sont
classés en cinq classes : A : feux de solides ; B : feux
de liquides ; C : feux de gaz ; D : feux de métaux. On y ajoute les
feux d'origine électrique E. Dans
quelle classe mettre les feux suivants :
papier filtre ( A) ; sodium( D)
; plastiques ( A) ; tétrachlorure de carbone ( B)
; chauffe ballon( E) ; butane ( C).
- Pour quel feu
utiliser vous de préférence les moyens suivants : sable ( feu de métaux type D) ; seaux d'eau ( feu de solide type A ); extincteur à eau avec additifs (feux de liquides type B) ; extincteur à CO2 (
feu d'origine
électrique) ;
extincteur à poudre ( feu
de gaz).
- La couleur de la
goupille permet de différentier les différents types d'extincteurs :
une goupille en acier , une goupille bleue, une goupille jaune.
Quelle est la couleur de la goupille des extincteurs : extincteur à eau
avec additif (bleue) ; extincteur à CO2 ( acier gris) ; extincteur à poudre (jaune).
|