|
|
étude
d'un produit d'entretient ( 5pts)
Données : H: 1,00 ; N
: 14,0 g/mol ; Ka = 6,3 10-10
; pKa = 9,2 ;
aide aux calculs :
1,6,3 = 0,16 ; 10,8*17,0=184 ; 184/920 = 2,00 10-1.
Sur l'étiquette d'une
solution commerciale d'ammoniac ( NH3) on lit :
% massique en ammoniac : 20 %.
On prépare 100 mL
d'une solution diluée, noté S au 20ème de la
solution commerciale , notée S0.
- La mesure du pH à 25°C de la solution diluée donne
pH= 11,2. Indiquer en justifiant la nature de cette solution.
- Préciser le nom et la formule de son espèce conjuguée.
- Ecrire le couple acide base auquel appartient l'ammoniac.
- Donner le diagramme de prédominance, en fonction du pH, des espèces
chimiques de ce couple et en déduire l'espèce prédominante dans la
solution S d'ammoniac.
- Pour vérifier les indications de l'étiquette on titre
un volume V= 10,0 mL de la solution S par une solution d'acide
chlorhydrique de concentration CA= 5,00 10-1
mol/L en présence de quelques gouttees de BBT. Le changement de teinte
de la solution a lieu pour un volume VA éq =
10,8 de solution titrante.
- Ecrire l'équation de la réaction support du dosage en précisant les
caractéristiques de cette transformation chimique.
- Etablir l'expression de la constante d'équilibre K en fonction de la
constante d'acidité Ka. Calculer sa valeur et
conclure.
- Déterminer la concentration molaire C de la solution S ; en déduire
la concentration C0 de la solution commerciale.
- La mesure de la masse volumique de la solution commerciale donne m= 920 g/L. Déterminer
l'expression du pourcentage massique de la solution commerciale en
fonction de C0, M et
m. Calculer sa valeur et conclure.
- Lors de ce titrage, la mesure du pH de la solution
lorsqu'on a versé un volume VA = 6,0 mL d'acide
chlorhydrique donne pH= 9,0.
- Déterminer les quantités de matière n1
d'ammoniac et n2 d'acide chlorhydrique
introduites.
- Détrminer l'avancement final, l'avancement maximal à l'aide d'un
tableau descriptif de l'évolution du système chimique.
- Montrer en calculant le taux d'avancement final t que la transformation est
quasi-totale.
corrigé
nature
de cette solution
S : pH supérieur à 7 à25°C, donc milieu basique
l'espéce
" acide conjugué "de l'ammoniac est l'ion ammonium NH4+.
couple acide base : NH4+
/ NH3.
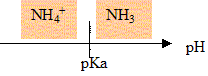
L'espèce
NH3 prédomine dans la solution S ( pH>pKa)
équation
de la réaction support du dosage
:
NH3 + H3O+
= NH4+ + H2O,
rapide et totale.
K=
[NH4+]/([H3O+][NH3])
= 1/Ka = 109,2 ; K est
très grand, la transformation est totale.
concentration molaire C de la
solution S
:
à
l'équivalence les réactifs mis en présence sont en proportions
stoechiométriques : C V= CA VA
éq
C
= CA VA éq /V
= 0,5*10,8 / 10 = 5,4 10-1
mol/L.
concentration C0 de la solution
commerciale : C0 = 20 C = 10,8 mol/L
expression du pourcentage massique de
la solution :
masse d'ammoniac pure dans 1 L : C0M
avec M : masse molaire ammoniac ( g/L)
masse de 1 L de solution : m
g ; %massique d'ammoniac p%= C0M*100 / m = 10,8*17*100/920 = 20 %,
valeur en accord avec l'indication de l'étiquette.
quantités
de matière n1 d'ammoniac et n2
d'acide chlorhydrique :
n1 =VC= 10 10-3*0,54
= 5,4 10-3 mol ; n2=CAVA=
0,5*6 10-3 = 3 10-3 mol
|
|
avancement (mol)
|
NH3
|
+ H3O+
|
= NH4+
|
+ H2O
|
|
initial
|
0
|
5,4 10-3
|
3 10-3
|
0
|
solvant en grand excès
|
|
en cours
|
x
|
5,4 10-3-x
|
3 10-3 -x
|
x
|
|
fin
|
xmax
|
5,4 10-3-xmax
|
3 10-3-xmax
|
xmax
|
|
xfin
|
5,4 10-3-xfin
|
3 10-3-xfin
|
xfin
|
|
acide en défaut d'où : 3 10-3-xmax
=0 soit xmax = 3 10-3 mol
3 10-3-xfin
= 10-pH * (10+6)
10-3= 1,6 10-11 mol soit xfin
= 3 10-3 mol
taux d'avancement final t
= xfin / xmax
= 1 ; la transformation est totale.
|
|
Synthèse organique ( 5
pts)
Données :le méthanol est un produit très inflammable et
toxique. L'acide salicylique et l'acide paratoluène sulfonique sont des
produits toxiques et irritants pour les yeux ; dméthanol/eau
= d = 0,79. Masse volumique de l'eau re=
1,0 103 g/L ; M( méthanol) = 32,0 g/mol.
aide aux calculs : 32/79 = 0,40 ; 79/32 = 2,47.
Le salicylate de méthyl est employé dans
l'agroalimentaire. Ce composé est synthétisé à partir de l'acide
salicylique ( HO-C6H4-CO2H(s)
) et du méthanol (CH3OH(l)). Dans un ballon on
introduit 2,7 g soit 0,200 mol d'acide salicylique solide, 100 mL de
méthanol et 15,0 mL d'acide paratoluène sulfonique servant de
catalyseur. On chauffe à reflux tout en agitant.
- Ecrire l'équation de la transformation chimique
permettant la synthèse du salicylate de méthyle.
- Le mélange initial est-il stoechiomètrique ?
- Quels facteurs cinétiques sont à considérer lors de
cette expérience ?
- Préciser les précautions à prendre pour préparer le
mélange réactionnel initial.
- Expliquer le principe du chauffage à reflux et
indiquer tout le matèriel nécessaire pour réaliser ce montage.
Pour suivre l'évolution de cette transformation cimique au cours du
temps, on prélève toutes les 15 min, le même volume du milieu
réactionnel, supposé homogène. On titre chaque échantillon par une
solution d'hydroxyde de sodium de concentration cB
en présence de phénolphtaléine. On considère dans ces conditions de
titrage que tout l'acide paratoluène sulfonique et l'acide carboxylique
présent sont neutralisés simultanément. On obtient les volumes vB de
solution de soude versé à l'équivalence pour chaque prélevement noté de
1 à 7.
|
n°
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
vB (mL)
|
24,0
|
19,0
|
16,5
|
15,5
|
15,0
|
14,9
|
14,9
|
|
n(a.s)t mmol
|
54,6
|
24,6
|
9,60
|
6,00
|
3,60
|
0
|
0
|
- Quel est le rôle des 14,9 mL de réactif titrant qu'il
est nécessaire d'ajouter dans les prélevements n°6 et 7 ?
- Pour chaque prélevement titré, les valeurs de vB
versé, de V et de CB permettent de calculer la
quantité de matière d'acide salicylique restant n(a.s)t
au cours du temps dans le mélange initialement préparé. Déduire de ces
valeurs les quantités de matière de salicylate de méthyle n(s.m)t
au cours du temps.
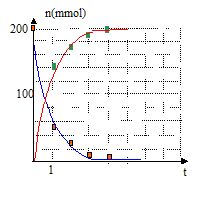
- Tracer dans le même repère n(a.s)t
et n(s.m)t au cours du temps.
- Calculer le taux d'avancement final pour les
prélevements n°1, 3 et 6. Conclure.
corrigé
équation
de la transformation chimique permettant la synthèse du
salicylate de méthyle :
HO-C6H4-CO2H(s)
+ CH3OH(l) = HO-C6H4-CO2CH3
+ H2O
Quantités
de matière initiales : n(acide salicylique) =0,2 mol ;
n(méthanol) = m/M = 100*0,79 / 32 = 79/32 = 2,47 mol
le
méthanol est en large excès, les réactifs réagissant mole à mole. Le
mélange initial n'est pas stoechiomètrique.
facteurs cinétiques : concentrations
des réactifs et température.
précautions à prendre pour préparer
le mélange réactionnel initial : port de blouse, gants, lunettes,
travail sous hotte.
principe du chauffage à reflux :
accélère la réaction ( travail à température modérée ) sans perte de
matière ( les vapeurs se condensent dans le réfrigérant droit et
retombent dans le milieu réactionnel.
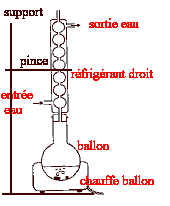
On peu ajouter un élévateur à croisillons sous le
chauffe ballon.
rôle des 14,9 mL de réactif titrant
qu'il est nécessaire d'ajouter dans les prélevements n°6 et 7 :
déterminer la quantité de matière d'acide paratoluène
sulfonique qui réagit avec la soude.
quantités de matière de salicylate de méthyle
n(s.m)t au cours du temps : 200-n(a.s)t
= n(s.m)t en mmol.
|
n°
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
n(a.s)t mmol
|
54,6
|
24,6
|
9,60
|
6,00
|
3,60
|
0
|
0
|
|
n(s.m)t en mmol
|
145
|
175
|
190
|
194
|
196
|
200
|
200
|
taux d'avancement final pour les
prélevements n°1, 3 et 6 : t
= n(s.m)t /200
t 1=
145/200 = 0,73 ; t 3=
190/200 = 0,95 ; t 6=
200/200 = 1 ;
à partir du prélèvement n°6, on peut affirmer que la
réaction est terminée.
|


