|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
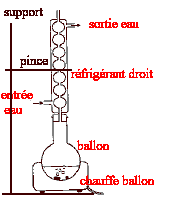
Données :le méthanol est un produit très inflammable et toxique. L'acide salicylique et l'acide paratoluène sulfonique sont des produits toxiques et irritants pour les yeux ; dméthanol/eau = d = 0,79. Masse volumique de l'eau re= 1,0 103 g/L ; M( méthanol) = 32,0 g/mol. aide aux calculs : 32/79 = 0,40 ; 79/32 = 2,47. Le salicylate de méthyl est employé dans l'agroalimentaire. Ce composé est synthétisé à partir de l'acide salicylique ( HO-C6H4-CO2H(s) ) et du méthanol (CH3OH(l)). Dans un ballon on introduit 2,7 g soit 0,200 mol d'acide salicylique solide, 100 mL de méthanol et 15,0 mL d'acide paratoluène sulfonique servant de catalyseur. On chauffe à reflux tout en agitant.
HO-C6H4-CO2H(s) + CH3OH(l) = HO-C6H4-CO2CH3 + H2O Quantités de matière initiales : n(acide salicylique) =0,2 mol ; n(méthanol) = m/M = 100*0,79 / 32 = 79/32 = 2,47 mol le méthanol est en large excès, les réactifs réagissant mole à mole. Le mélange initial n'est pas stoechiomètrique. facteurs cinétiques : concentrations des réactifs et température. précautions à prendre pour préparer le mélange réactionnel initial : port de blouse, gants, lunettes, travail sous hotte. principe du chauffage à reflux : accélère la réaction ( travail à température modérée ) sans perte de matière ( les vapeurs se condensent dans le réfrigérant droit et retombent dans le milieu réactionnel.
On peu ajouter un élévateur à croisillons sous le chauffe ballon. rôle des 14,9 mL de réactif titrant qu'il est nécessaire d'ajouter dans les prélevements n°6 et 7 : déterminer la quantité de matière d'acide paratoluène sulfonique qui réagit avec la soude. quantités de matière de salicylate de méthyle n(s.m)t au cours du temps : 200-n(a.s)t = n(s.m)t en mmol.
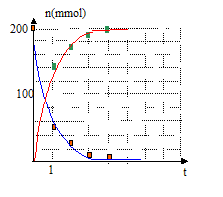
taux d'avancement final pour les prélevements n°1, 3 et 6 : t = n(s.m)t /200 t 1= 145/200 = 0,73 ; t 3= 190/200 = 0,95 ; t 6= 200/200 = 1 ; à partir du prélèvement n°6, on peut affirmer que la réaction est terminée.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
|