|
|
|||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||
|
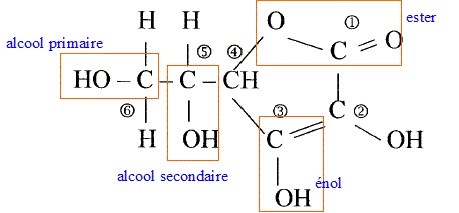
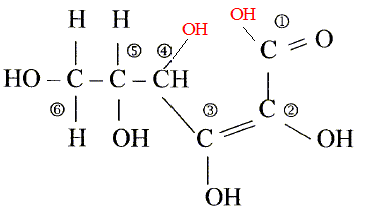
L'acide ascorbique ou vitamine C est un actif utilisé en cosmétologie dans les crèmes anti_rides comme agent anti-radicalaireset anti-inflamatoire. On le trouve sous la forme de l'acide pur , soit sous la forme estérifiée. On donne la formule développée de l'acide ascorbique : 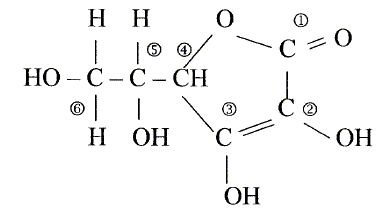
Les numéros permettent de repérer les atomes de carbone.
corrigé formule btute : C6H8O6. carbone asymétrique : carbone tétragonal portant quatre atomes ou groupes d'atomes différents : atome de carbone n°5
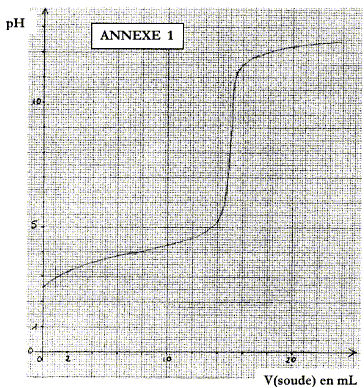
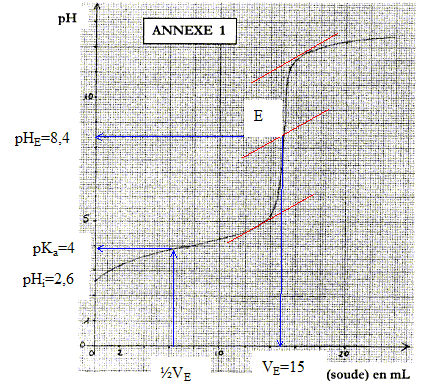
molécule qui serait à l'origine de cette lactone : équation de la réaction acido-basique correspondant à ce titrage : HA + HO- = A- + H2O
espèces chimiques majoritaires à l'équivalence : base conjuguée ion ascorbate A- ; ion sodium Na+ spectateur. La présence d'une base à l'équivalence implique pHE supérieur à 7. La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent : d'où le choix du rouge de crésol. concentration molaire en acide ascorbique dans la solution S initiale : à l'équivalence les quantités de matière des réactifs sont en proportions stoéchiométriques : CAVA=CBVE soit CA =CBVE / VA= 0,1*15/20 = 0,075 mol/L. Soit 0,0075 mol d'acide ascorbique dans 0,1 L de solution initiale. masse (g) = masse molaire (g/mol) * quantité de matière (mol) = 176*0,0075 = 1,3 g. pHi=½(pKa-log C) donne log C= pKa-2pHi= 4-2*2,6 = -1,2 soit C= 0,063 mol/L.
|
|||||||||||||||||||||||||||||||||||
|
Le schéma de principe d'un spectrophotomètre d'absorption peut être réduit à la figure ci-dessous :  La cuve de longueur L contient la solution étudiée. La transmittance T correspond au rapport du flux lumineux émergent IT sur le flux incident I0.
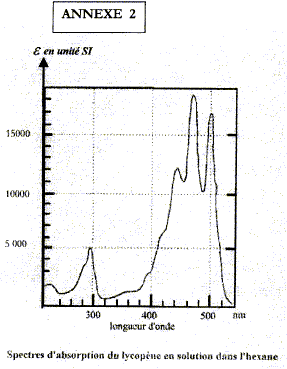
corrigé la loi de Beer Lambert Al=elLc est vérifiée si la solution a une concentration inférieure à : c < 0,1 mol.L-1 et si on utilise une lumière monochromatique. A absorbance, grandeur sans unité ; e coefficient d'absorbance (m2 mol-1) ; c : concentration de l'espèce absorbante en mol m-3; L : largeur cuve (m). Alet el dépendent de la longueur d'onde d'où l'indice l. les pics d'absoptions supérieurs à 400 nm sont situés dans le domaine [420 ; 520 nm] : la solution absorbe l'indigo, le bleu et une partie du vert ; cette solution aura donc une couleur jaune orange. longueur d'onde correspondant à un photon dont l'énergie est 4,2 eV : E= hc/l soit l = hc/E E = 4,2*1,6 10-19 =6,72 10-19 J l =6,62 10-34*3 108 /6,72 10-19 =2,96 10-7 m = 296 nm. la courbe présente un pic d'absorption vers 290 ; 300 nm : ce photon est donc absorbé. absorbance d'une solution de lycopène de concentration molaire 2,0 10-6 mol/L pour l1= 500 nm e500 = 17 000 SI (lecture graphe) ; c = 2,0 10-3 mol m-3 ; L= 10-2 m ; A= 17000*2,0 10-3 *10-2 = 0,34. m= 0,86*50/1,4 = 30,7 mg soit en pourcentage : 30,7 / 600*100 = 5,2 %, accord avec ce qui est annoncé |
|||||||||||||||||||||||||||||||||||
|
|