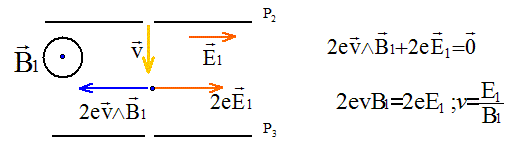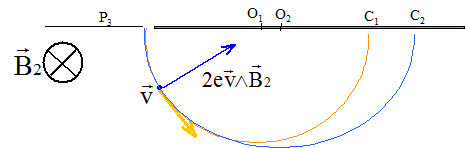|
|
||||
|
||||
|
On considère un moteur à combustion interne à allumage par bougies. On se limite à l'étude de l'un des cylindres du moteur. Le cycle thermodynamique décrit par le fluide est le cycle de Beau et Rochas. 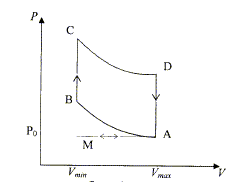 M-A : admission du mélange gazeux air essence à la pression P0. En A il y a fermeture de la soupape d'admission et le volume V est alors égal à Vmax. A-B compression adiabatique réversible du mélange. Dans l'état B, le volume est égal à Vmini. B-C : échauffement isochore du gaz. C-D : détente adiabatique réversible du gaz. On convient de nommer "taux de compression" le rapport t=Vmax/Vmin ; ici t=10. Le système envisagé est le gaz qui décrit le cycle ABCD. La quantité de gaz, n, est celle qui a été admise dans l'état A. L'échauffement de l'étape BC est dû à la combustion "interne" du mélange gazeux admis. Les réactifs et les produits de la réaction sont gazeux. On admettra que la quantité de gaz n'est pas modifiée par la combustion interne. Le gaz est assimilé à un gaz parfait pour lequel les capacités molaires Cpm et Cvm sont constantes. Cvm = R/(g-1) et g =Cpm/Cvm=1,33.
corrigé Expression de Q1 quantité de chaleur échangée dans l'étape B-C : Q1 = nCvm( TC - TB ) avec ( TC - TB )>0 échauffement du gaz Q1 >0, chaleur reçue par le système, le gaz. Expression de Q2 quantité de chaleur échangée dans l'étape D-A : Q2 = nCvm( TA - TD ) avec ( TA - TD )<0 refroidissement du gaz Q2 <0, chaleur cédée par le système, le gaz. Expression du travail total W échangé au cours du cycle ABCD : l'énergie interne du gaz ne varie pas au cours du cycle : DU=0 Or DU=W+ Q1 +Q2 d'où W= -(Q1 +Q2) Expression de h en fonction de Q1 et Q2. efficacité ( rendement) : |travail fourni |/ énergie reçue à la source chaude ; h = |W|/Q1 = |-(Q1 +Q2)|/Q1 =|-(1+Q2/Q1 )| or Q1>0 et Q2<0 d'où h =1-|Q2| /Q1 expression de h en fonction de TA, TB, TC et TD : |Q2| /Q1 = | TA - TD | / ( TC - TB ) ; h = 1- | TA - TD | / ( TC - TB ) A-B adiabatique d'onc : TAVg-1maxi =TBVg-1mini (1) ; C-D adiabatique d'onc : TDVg-1maxi = TCVg-1mini (2) (1) -(2) donne : (TA - TD )Vg-1maxi = ( TB - TC )Vg-1mini ; (TA - TD )/ ( TB - TC ) = Vg-1mini / Vg-1maxi = (Vmini / Vmaxi)g-1 = t1-g h = 1- t1-g =
1-10-0,33
=
0,53.
Calcul de Vmaxi et
Vmini : Vmaxi-Vmini = 2 soit 9 Vmin = 2 ; Vmin =2/9 = 0,22 L ; Vmaxi = 2,22 L. Calcul de la quantité de gaz n' ( mol) de carburant consommée par le cycle : Relation des gaz parfaits pour l'état A : PAVmaxi = n RTA ; n= PAVmaxi /(RTA) = 105*2,22 10-3 / (8,31*320)=8,36 10-2 mol n'= n/60 = 1,4 10-3 mol.
|
||||
|
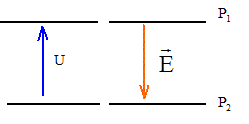
On négligera les effets de la pesanteur devant les autres actions ; la masse des électrons est négligeable devant la masse des ions. 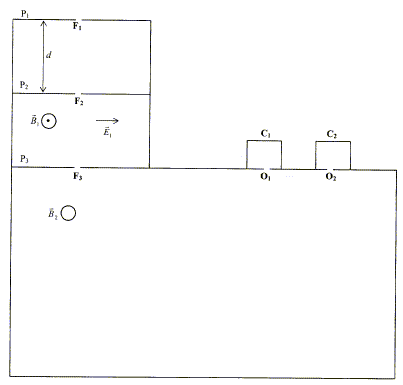 On considère des plaques P1 et P2 parallèles, situées à une distance "d "l'une de l'autre. Une différence de potentielle constante U est appliquée entre P1 et P2.
corrigé Des ions positifs de masse m et de charge q sont émis par une source ( située en F1), normalement à la plaque P1, avec une vitesse initiale considérée comme nulle. Les ions positifs pourront atteindre la plaque P2 si celle-ci porte une charge négative ( des charges de signe contraire s'attirent) en conséquence le potentiel électrique de P2 est inférieur à celui de P1 : le champ électrique est dirigé vers le plus petit potentiel.
th. de l'énergie cinétique entre P1 et P2 : (le poids est négligeable devant la force électrique) le travail de la force électrique est : q U ; ce travail doit être moteur pour que les ions soient accélérés. la vitesse initiale en F1 est
nulle : ½ m v²0- 0 = q U d'où v²0 = 2 q U / m
; v0 =[2 q U
/ m]½.
Calcul de v1 et v2 pour ces deux types d'ions arrivant sur la plaque P2 : m1 = 200 * 1,67 10-27 = 3,34 10-25 kg ; m1 = 202 * 1,67 10-27 = 3,3734 10-25 kg ; q= 2*1,6 10-19 = 3,2 10-19 C ; 2qU= 6,4 10-15. v1 = [6,4 10-15/ 3,34 10-25 ]½=1,384 105 m/s v2 = [6,4 10-15/
3,3734 10-25 ]½=1,378 105 m/s
Ces ions traversent ensuite la plaque P2
par la fente F2, le vecteur vitesse des ions
étant ortogonal à P2. Ils pénètrent dans
l'espace séparant P2 et P3
où règnent : - un champ électrique uniforme de valeur E1,
parallèle à P2 et à P3,
dans le plan de la feuille ; - un champ magnétique uniforme de valeur B1,
perpendiculaire au plan de la feuille.
Si E1 = 5,3 104 V et B1 = 0,383 T, v = 5,3 104 / 0,383 =1,384 105 m/s. Seul l''isotope du mercure 20080Hg2+
remplit ces conditions.
Les ions ne sont soumis qu'à la force magnétique.
Cette force est perpendiculaire à la vitesse : en conséquence son travail est nul et l'énergie cinétique d'un ion ne varie pas. La valeur de la vitesse d'un ion reste constante : le mouvement est uniforme. La deuxième loi de Newton , ( suivant un axe perpendiculaire à la vitesse, dirigé vers le centre du cercle ) s'écrit : 2evB2 = mv²/R d'où R= mv/ ( 2eB2)
= constante Calcul de la distance d=O1O2 =2 (R2-R1) R1= m1v1/ ( 2eB2) = 3,34 10-25* 1,384 105 / (3,2 10-19*0,2)=0,7224 m ; R2= m2v2/
( 2eB2) = 3,3734 10-25* 1,378 105 / (3,2 10-19*0,2)=0,7260
m ; d=O1O2
=2 (R2-R1) = 7,2
mm.
composition du mélange d'ions : Les quantités d'électricité reçues en une minute par les collecteurs C1 et C2 sont proportionnelles au nombre d'ions. 20080Hg2+ : Q1/(Q1+Q2)*100 = 77,4 %. 20280Hg2+: Q2/(Q1+Q2)*100 = 22,6 %.
|
||||
|
|