|
|
|||||||||||||||||||
|
|||||||||||||||||||
|
Les trois questions sont indépendantes : Le plomb :
corrigé composition complète d'un atome de plomb de l'isotope 208 : Z= 82 donc 82 électrons, 82 protons et 208-82 = 126 neutrons. La structure électronique du plomb est : [Pb]=[Xe] 4f14 5 d10 6s2 6 p2, [Xe] représente la structure électronique du xénon. La structure électronique de l'ion Pb2+
est : [Xe] 4f14 5 d10 6s2 Le plomb et le carbone ont la même structure électronique externe (n s2 n p2) : ils se trouvent donc dans la même colonne de la classification périodique.
PbCl2(s) = Pb2+
+ 2Cl-. Masse molaire PbCl2 : M= 207+2*35,5 = 278 g/mol ; 4,4 g de ce solide dissouts dans 1 L s = 4,4/278 = 1,58 10-2 mol/L Ks = [Pb2+][Cl-]2
avec [Cl-] = 2 s ; Ks =
s*(2s)² = 4 s3 = 4 ( 1,58 10-2)3
= 1,58 10-5.
PbSO4 (s) = Pb2+ +SO42- Ks = [Pb2+][SO42-] avec [Pb2+]=[SO42-] = s s = Ks½ = (1,6 10-8)½ = 1,26 10-4 mol/L cette valeur est inférieure à la solubilité du chlorure de plomb(II) Le chlorure de plomb(II) est plus soluble que le sulfate
de plomb(II) dans l'eau à 25 °C.
diagramme de prédominance des espèces : Equation de la réaction de dosage sachant que H+ est libéré et que PbY2- est formé : Pb2+ + H2Y2-
= 2H+ + PbY2- à l'équivalence les quantités de matière des réactifs sont en proportions stoechiomètriques : n( Pb2+) = n(H2Y2-) cPb2+ = 26,7*5 10-3/25
= 5,34 10-3 mol/L
|
|||||||||||||||||||
|
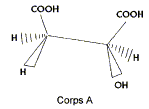
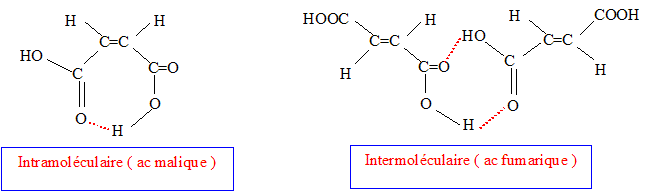
On s'intéresse aux acides (Z) but-2-ène-1,4 dioïque ( acide malique) et (E) but-2-ène-1,4 dioïque ( acide fumarique).
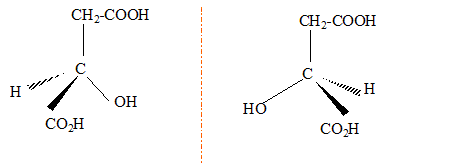
corrigé L'acide fumarique estreprésenté par la formule 2 :  Les molécules 1 et 2 sont diastéréisomères : isomérie Z E, pas de libre rotation autour de la liaison double C=C. Les deux molécules ne sont pas image l'une de l'autre
dans un miroir : ce ne sont pas des énantiomères.
L'étape lente de l'hydratation conduit à la formation
d'un carbocation plan. Lors de la seconde étape, l'attaque rapide de HO-
s'effectue indifféremment d'un côté ou de l'autre du carbocation plan.
Le mélange obtenu n'est pas optiquement actif : mélange racémique, 50%
de chaque énantiomère.
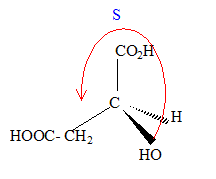
numéroter de façon décroissante chacun des quatre substituants selon son numéro atomique. OH (1) ; COOH (2) ; CH2COOH (3) ; H (4). On place alors l'atome (ou le groupement) de numéro le plus élevé derrière. On regarde dans quel sens, sens horaire ou trigonométrique, on passe du numéro 1, au 2, au 3. - Si le sens de rotation est le sens horaire (ou anti-trigonométrique), le carbone est Rectus (R), - Si le sens de rotation est le sens trigonométrique (ou
anti-horaire), le carbone est Sinister (S).
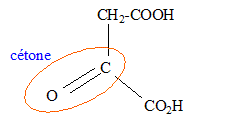
Dans le cas d'un alcool secondaire, oxydation ménagée de la fonction alcool en cétone ; l'oxydant est l'ion permanganate MnO4- en milieu acide.
|
|||||||||||||||||||
|
Les deux questions sont indépendantes.
corrigé Les quatre isomères possibles pour un alcool de formule C4H10O :
Les deux singulets du spectre RMN montre la présence de deux type de protons ; de plus les atomes les plus proches voisins ne portent pas d'hydrogène. d'où le choix : 2-méthylpropan-2-ol
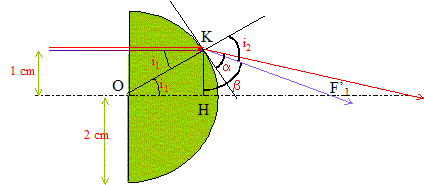
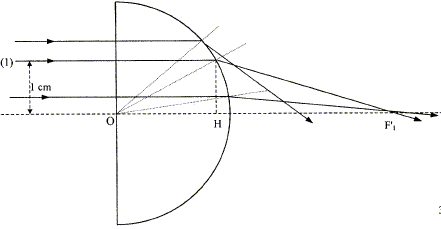
aberration géométrique ( sphérique) :
un faisceau parallèle incident ne converge pas en un point ; on observe
une tache étalée le long de l'axe optique principal. L'image d'un objet
étendu n'est pas nette.
OF'1 = OH+HF'1 ; OH= (OK2-HK2)½ =(2²-1²) ½ = 1,73 cm. sin i1 = KH/OK= 0,5 ; i1 = 30° loi de Descartes por la réfraction : 1*sin i1 = 1,5 sin i2 soit i2 = 48,6 °; a= 90-48,6 =41,4 ; b= a+ i1 =71,4° HF'1 = KH tan b= 2,97 cm ; d'où OF'1
=1,73+2,97 = 4,7 cm.
|
|||||||||||||||||||
|
|
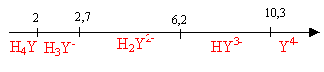
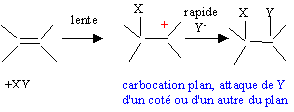
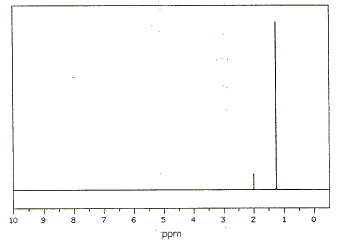
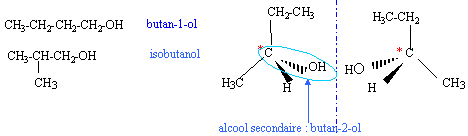
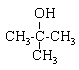 2-méthylpropan-2-ol
2-méthylpropan-2-ol 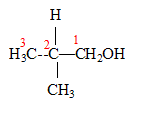 2-méthylpropan-1-ol
2-méthylpropan-1-ol