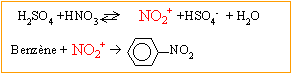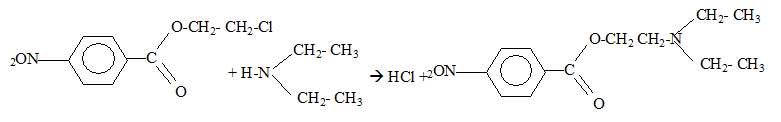|
|
||||||||||||||||
|
||||||||||||||||
|
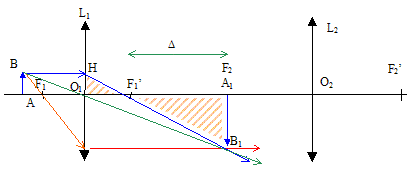
Un microscope optique comporte un oculaire de grossissement x10 et un objectif de grandissement x40. L'ouverture numérique ( n sin u) de l'objectif vaut 0,65 et l'intervalle optique D est de 16 cm. Ce microscope est modélisé par l'association de deux lentilles convergentes, de même axe optique, et il est réglé pour donner une image A'B' à l'infini d'un objet AB réel, perpendiculaire à l'axe optique.
corrigé 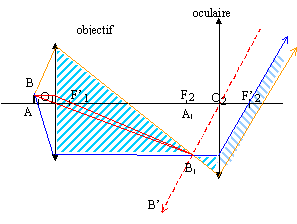
grandissement de l'objectif : les distances algèbriques sont écrites en bleu et gras. g = A1B1/AB. La valeur absolue du grandissement |g| est écrite sur la monture de l'objectif : |g| = 40. grossissement commercial et puissance intrinsèque : Le grossissement du microscope G est égal au produit du grandissement de l'objectif et grossissement de l'oculaire. Grandissement de l’objectif et grossissement de l’oculaire sont habituellement gravés sur les montures de ces éléments. G = |g| Goc= 40*10 = 400 d ( dioptries) Puissance intrinsèque = 4 G = 1600 d. distance focale image de l'objectif :
Les côtés des deux triangles hachurés O1HF'1 et A1B1F'1 sont proportionnels : A1B1 / O1H = A1F'1 / O1F'1 ; or O1H = AB ; A1F'1 = -D et A1B1 /AB = g ; d'où g = -D / O1F'1 = -D / f'1. f'1 = -D / g =0,16 / 40 = 4 10-3 m = 4 mm. distance focale image de l'oculaire : Le grossissement commercial de l'oculaire est égal à 0,25 fois la vergence de l'oculaire : voc = 10/0,25 = 40 ; f'2 = 1/40 = 0,025 m = 25 mm. distance du centre optique O1de l'objectif à l'objet AB pour avoir une image finale A'B' à l'infini : utiliser la formule de conjugaison : 1/ O1F'1 = 1/O1A1 -1/O1A avec O1A1 = D + f'1 = 0,164 m 1/O1A = -1/ O1F'1 + 1/O1A1 =-1/ 4 10-3 + 1/ 0,164 ; O1A = -4,1 10-3 m. Le pouvoir séparateur du microscope est donné par : e = 0,6 l /( nsin u) avec nsin u = 0,65 Si l = 500 nm e = 0,6 *500 10-9/0,65 = 4,6 10-7 m = 0,46 mm. la plus petite distance entre deux points de l’objet qui sont vus séparés à travers l’instrument vaut 0,46 mm. Donc il est possible d'observer un staphylocoque de 1mm à traves le microscope.
|
||||||||||||||||
|
On considère la réaction de fusion suivante : 31X + 21Y --->baZ + 01n
1 u = 1,66 10-27 kg ; 1 u = 931,5 MeV c² ; MZ= 4,0 g/mol ; MX= 3,0 g/mol ; 1 eV= 1,6 10-19 J ; NA= 6,02 1023 mol-1. corrigé 31X + 21Y --->baZ + 01n Détermination des symboles chimiques X, Y, Z ainsi quedes valeurs de a et b : Le numéro atomique de X et Y est 1 : il s'agit de
l'élément hydrogène conservation de la charge : 1+1=a d'où a= 2 ; on identifie Z à l'élément hélium. 31H + 21H --->42He + 01n Les réactions de fusion dans l'univers, se produisent
dans les étoiles.
31H ---> AZX + -10 e particule b- ou électron conservation du nombre de nucléons : A=3 ; conservation
de la charge : Z= 2 ; on identifie X à He.
l t½=ln2
soit l=ln2/ t½=ln2
/ 12,3 = 5,64 10-2 an-1 =
ln2/(12,3*365*24*3600)= 1,79
10-9 s-1.
quantité de matière (mol) = masse (g) / masse molaire (g/mol) = n = 0,1/3 = 3,33 10-2 mol nombre de noyaux contenus dans cet échantillon : N0=nNA=
3,33 10-2* 6,02 1023 =2,0 1022
noyaux.
N30 = N0 exp(-30l) = 2 1022 exp(-30/12,3) = 2 1022 *0,1844 = 3,68 1021 noyaux. l'activité de cet échantillon sera : A30
= lN30
= 1,79 10-9 * 3,68 1021
= 6,58 1012
Bq.
|Dm|= |mn+mZ -mX-mY | =| 1,0087+4,0026 -2,0136-3,0155|= 1,78 10-2 u E= 1,78 10-2 * 931,5 = 16,58 MeV ou bien 16,56 106/1,6 10-19 = 2,65 10-12 J.
quantité de matière (mol) = masse (g) / masse molaire (g/mol) = n = 10/4 = 2,5 mol nombre de noyaux contenus dans cet échantillon : N0=nNA= 2,5* 6,02 1023 =1,5 1024 noyaux. E= 2,65 10-12 * 1,5 1024 = 4 1012 J. Comparaison de cette énergie avec celle libérée par la combustion d'une tonne de pétrole ( 4,2 1010 J) : 4 1012 / 4,2 1010 = 95 tonnes de pétrole.
|
||||||||||||||||
|
Le dihydrogène peut être produit selon la réaction suivante : CH4(g) + H2O(g) = CO(g) + 3H2(g) Données à 298 K :
corrigé enthalpie de réaction, notée DrH°1 à 298 K : DrH°1 =DrH°(CO) + 3DrH°(H2)- DrH°(CH4) -DrH°(eau) DrH°1 = -110,52 + 3*0 +241,43+74,85 = 205,8 kJ mol-1. valeur positive, la réaction est endothermique.
DrS° =S°(CO) + 3S°(H2)- S°(CH4) -S°(eau) DrS° =3*130,6+197,9-188,7-186,2 = 214,9 J mol-1 K-1. la stoechiométrie de la réaction donne Dn =2 ( le nombre de moles de
produits est supérieur au nombre de moles des réactifs : donc DrS°
>0.
DrG°1
= DrH°1
-TDrS°
=205,8 103 -298 *214,9 = 141,8 103
kJ/mol.
DrG°1 = -RT ln K ; ln K = -DrG°1 /(RT) = -141,8 103 / (8,31*298) = -57,2 ; K= 1,35 10-25. K est très faible : l'équilibre est fortement déplacé
vers la gauche (réaction inverse)
DrG°1 = DrH°1 -TinversionDrS° =0 Tinversion = DrH°1/DrS° =205,8 103 / 214,9 = 958 K.
|
||||||||||||||||
|
La synthèse de la procaïne peut être réalisée de la manière suivante :
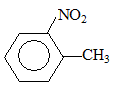
corrigé La nitration du toluène C6H5-CH3 permet d'obtenir majoritairement le composé A : 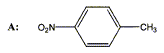 A : 4-nitrotoluène ; cette nitration s'effectue en présence du mélange sulfonitrique.
Il se forme également
un composé A' minoritaire( le groupe CH3 oriente
une seconde substitution en para et en ortho, mais en position il y a
gène stérique) : A' est le 2-nitrotoluène ; L'oxydation par les
ions permanganate à chaud en milieu acide du composé A conduit à
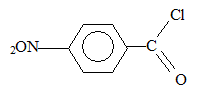
l'acide 4- nitrobenzoïque B de formule semi-développée / demi-équations électroniques : ( couple MnO4-/Mn2+) : MnO4- + 8H+ + 5e-= Mn2++ 4H2O réduction (1) ( couple C7H5NO4
/ C7H7NO2)
: C7H7NO2
+ 2H2O = C7H5NO4+
6H+ + 6e- oxydation (2) 6 fois (1) + 5 fois (2) donne : 6MnO4- +18H+ +5C7H7NO2 =6 Mn2++ 14H2O + 5C7H5NO4. La fonction acide
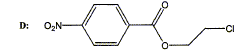
carboxylique de B est activée par le chlorure de thionyle SOCl2
selon l'équation : B+SOCl2 = C+SO2+HCl L'action de C sur le composé HO-CH2-CH2-Cl conduit à la formation d'un composé D et de chlorure d'hydrogène selon : C+ HO-CH2-CH2-Cl = D + HCl
type de réaction :
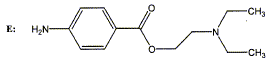
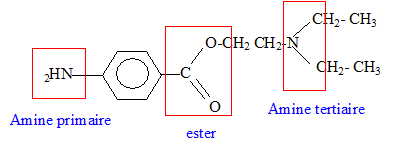
estérification D est traitée par (C2H5)2NH
pour donner le composé E de formule brute : C13H18N2O4.
type de réaction : substitution La réduction de E par
le fer en milieu acide conduit à la procaïne :
|
||||||||||||||||
|
|
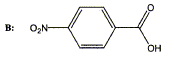 .
Ecrire les demi-équations électroniques ( couple MnO4-/Mn2+)
.
Ecrire les demi-équations électroniques ( couple MnO4-/Mn2+)