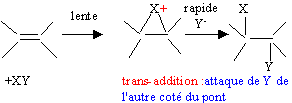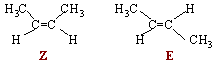|
|
||||
|
||||
|
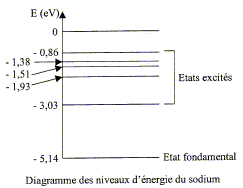
Le numéro atomique de l'élément sodium est Z=11. L'analyse du spectre d'émission d'une lampe à vapeur de sodium révèle la présence de raies de longueurs d'onde bien définies : 
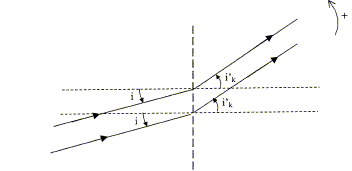
On rappelle la formule d'un réseau à n traits mm-1 : sin ik' -sin i = kln, définissant pour une incidence i les directions ik' dans lesquelles se trouvent les maximas de lumière d'une radiation monochromatique de longueur d'onde l.
corrigé structure électronique de l'élément sodium : 11 électrons dans l'état fondamental :1s2 2s2 2p6 3s1. domaine de longueurs d'ondeauquel appartiennent ces radiations : l1 < 400 nm donc domaine U V. l2 , l3 , l'3, l4 : domaine visible l5 , l6, valeurs supérieures à 800 nm : domaine I R. Calcul de la fréquence de la radiation jaune de longueur d'onde l3=589,0 nm = 5,89 10-7 m n = c/l3 =3 108 / 5,89 10-7 = 5,09 1014 Hz. Calcul de l'énergie ( en J et en eV) des photons correspondants : E= hc/l3 = 6,63 10-34*3 108 / 5,89 10-7 =3,38 10-19 J ; diviser par 1,6 10-19 : 2,11 eV. En utilisant le diagramme simplifié des niveaux d'énergie de l'atome de sodium, on trouve que l'écart énergétique entre le niveau excité n=1 et le fondamental vaut : -3,04+5,14 = 2,11 eV ; cette radiation jaune correspond donc à la transition de l'état excité 1 vers l'état fondamental. Un atome de sodium à l'état fondamental ne peut pas absorber un photon d'énergie 3 eV : l'énergie du photon doit être égale à la différence d'énergie entre un état excité et l'état fondamental.
La formule des réseaux traduit le fait que dans la direction définie par sin ik' pour un angle i donné, les ondes diffractées par toutes les fentes sont en phase. n: nombre de traits par unité de longueur a=1 / n pas du réseau k appartient à Z k est appelé l'ordre l longueur
d'onde (m) de la lumière utilisée.
Calcul des angles ik' des directions dans lesquelles on a des maxima de lumière pour une radiation de longueur d'onde l = 589 nm. n = 750 traits / mm. le nombre de maxima principaux est fini : pour i =0 ; n =7,5 105 traits m-1 ; l=589 10-9 m sin ik' = kln soit sin ik' = 7,5 105 *589 10-9 k= 4,417 10-1 k k=0 donne i0' =0 ; k =1 donne i1'
= + ou - 26,21°; k =2 donne i2' = + ou - 62,06°.
Calcul de l'écart angulaire D ik' entre les directions ik' des maxima des radiations à l3 = 589 nm et l'3 =589,6 nm du spectre du sodium. sin ik' = 7,5 105 *589,6 10-9
k= 4,422 10-1 k - à l'ordre k=2 : i2'
= + ou - 62,18°; D
ik' = 0,12 °
A l'ordre k=1, le pouvoir séparateur vaut : R= N= 7,5 105*0,02 = 1,5 104 traits utilisés ; l/Dlm = 589 10-9 / 0,6 10-9
= 982 ; R > l/Dlm
|
||||
|
pKa du couple (NH4+ / NH3) = 9,20 à 25°C ; 11H ; 147N. L'ammoniac est un gaz moléculaire de formule NH3 très soluble dans l'eau.
corrigé Structure : modèle de Lewis de la molécule d'ammoniac. 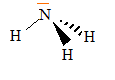 géométrie de la molécule d'après la théorie VSEPR : type AX3E donc pyramide à base triangulaire pH d'une solution : L'ammoniac est donc une base selon Lewis.. couples acide base mis en présence : NH4+ / NH3 et H2O / HO-. NH3 + H2O = NH4+ + HO-. On souhaite préparer une solution tampon à partir de
l'ammoniac. modère la variation du pH, faisant suite à l'ajout
modéré d'acide ou de base forte. Les concentrations de la base NH3
et de son acide conjugué NH4+
sont égales : en conséquence pH=pKa = 9,2.
|
||||
|
On souhaite, en deux étapes passer du but-1-ène au but-2-ène. Dans un premier temps le but-1-ène est hydraté à froid en milieu acide sulfurique dilué. On obtient majoritairement un produit A.
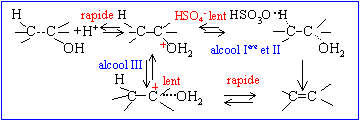
corrigé équation bilan conduisant à A : CH3-CH2-CH=CH2 + H2O = CH3-CH2-CHOH-CH3 : butan-2-ol mécanisme réactionnel de la réaction en justifiant la formation majoritaire de A:
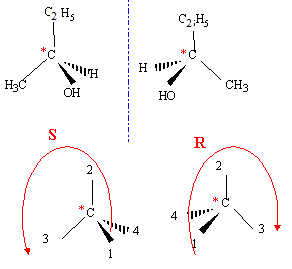
La règle de Markovnikov permet de prévoir sur quel atome de carbone se fixe l'hydrogène de l'hydracide ( ou de H2O) : l'atome d'hydrogène se fixe sur l'atome de carbone le moins substitué. Le produit A possède des stéréoisomères ; représentation de Cram et nomenclature RS.
Le composé A est maintenant déshydraté en milieu acide sulfurique concentré à 150 °C. équation bilan de la réaction précédente : CH3-CH2-CHOH-CH3
= CH3-CH=CH-CH3 + H2O Dans le cas ou plusieurs atomes de carbone sont porteurs d'hydrogènes pouvant être éliminés, l'alcène le plus substitué se forme.
Le but-2-ène présente une stéréoisomérie de type Z E :
|
||||
|
|