|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
..
.
|
Le vert de bromocrésol est un indicateur coloré acido-basique. C'est un couple acide-base dont l'acide noté HInd et la base notée Ind- possèdent deux couleurs différentes : la forme acide est jaune tandis que la forme basique est bleue. Le but de cet exercice est de déterminer la valeur de la constante d'acidité du vert de bromocrésol par deux méthodes différentes. Détermination de la constante d'acidité du vert de bromocrésol par pH-métrie : On dispose d'une solution commerciale S de vert de bromocrésol à 0,02 % en solution aqueuse. La concentration molaire en soluté apporté de cette solution est c = 2,9 10- 4 mol L-1 . Après avoir étalonné un pH-mètre, on mesure le pH d'un volume V = 100,0 mL de la solution S, on trouve un pH égal à 4,2.
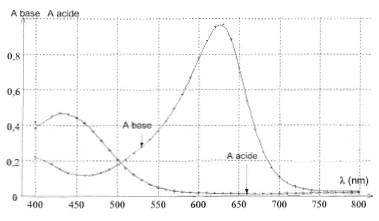
Détermination de la constante d'acidité du vert de bromocrésol par spectrophotométrie : À l'aide d'un spectrophotomètre, on relève l'absorbance des formes acide et basique du vert de bromocrésol. On obtient les courbes suivantes :
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
corrigé Détermination de la constante d'acidité du vert de bromocrésol par pH-métrie : On dispose d'une solution commerciale S de vert de bromocrésol à 0,02 % en solution aqueuse. La concentration molaire en soluté apporté de cette solution est c = 2,9 10- 4 mol L-1 . Après avoir étalonné un pH-mètre, on mesure le pH d'un volume V = 100,0 mL de la solution S, on trouve un pH égal à 4,2. Equation de la réaction de l'acide HInd avec l'eau : HInd + H2O = Ind- +H3O+ Valeur de l'avancement final xf de la réaction entre l'acide HInd et l'eau :
Taux d'avancement final t de cette réaction : xf / xmax =6,3 10-6 /2,9 10- 5 = 0,22. t <1 : la transformation de l'acide HInd avec l'eau est partielle. Expression de la constante d'acidité Ka de l'indicateur en fonction du pH de la solution et de la concentration molaire en soluté apporté c de la solution S : Ka =[Ind-][H3O+]/[HInd ] avec [Ind-]=[H3O+] = 10-pH ; conservation de Ind : [Ind-] + [HInd ] = c soit [HInd ] = c -[HIn-] = c- 10-pH ; par suite : Ka =10-2pH /(c- 10-pH ) Valeur de Ka : Ka =10-8,4 /(2,9 10- 4- 10-4,2 ) = 10-8,4 /2,27 10-4 = 1,8 10-5. Valeur du pKa du vert de bromocrésol : -log Ka
= - log 1,7 10-5 = 4,8
Longueur d'onde l du spectrophotomètre afin que l'absorbance de la forme acide soit quasiment nulle et celle de la forme basique du vert de bromocrésol soit maximale : l = 620 nm.
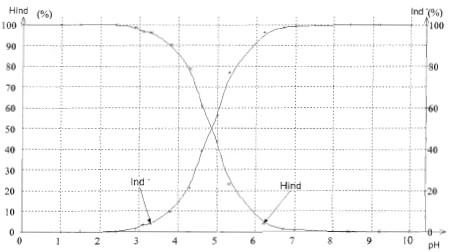
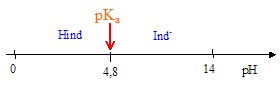
Point du diagramme de distribution des espèces pour lequel [HInd] = [Ind -] : ordonée 50 % : l'abscisse corespondante est pH=pKa = 4,8. Diagramme de prédominance du couple HInd/Ind - :
A partir du tableau, intervalle des valeurs de pH pour lesquelles le vert de bromocrésol prend sa teinte sensible verte : 3,8<pH<5,3. Cet intervalle s'appelle " zone de virage". On considère que le vert de bromocrésol prend sa teinte acide lorsque [HInd]/[Ind- ]> 10 et qu'il prend sa teinte basique lorsque [Ind- ] /[HInd]> 10. En utilisant la relation pH = pKa + log [base]/[acide], calcul l'intervalle de pH pour lequel [Hlnd] et [Ind- ] sont considérées voisines. teinte acide jaune si [HInd]/[Ind- ]> 10 ; [Ind- ] /[HInd] <0,1 soit log[Ind- ] /[HInd]<-1 d'où pH<4,8-1 = 3,8. teinte basique bleue si [Ind- ] /[HInd]> 10, soit log[Ind- ] /[HInd]>1 d'où pH>4,8+1 = 5,8. Cet intervalle est cohérent avec celui trouvé à partir du
tableau ( dans le tableau, il faudrait davantage de mesures vers pH=3,5
et vers pH = 5,5).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||