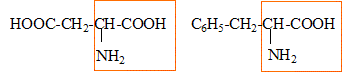|
Les savons, un dipeptide : l'aspartame , Les ondes électromagnétiques: radiations UV et IR d'après bac SMS 2006 |
||||
|
||||
|
|
A. Le lavage : Pour se laver, il utilise m = 4,0 g d'une savonnette constituée uniquement d'oléate de sodium.
B. Le rinçage : Eric se rince : sur les 4,0 g de savon utilisés, m1 = 3,0 g d'oléate de sodium se retrouvent dissous dans l'eau du bain.
C. Evacuation de l'eau savonneuse : Eric sort du bain, se sèche et enlève le bouchon de la baignoire pour la vider. Mais l'écoulement de l'eau se fait très lentement car les canalisations sont encombrées de graisses, cheveux... Eric utilise alors un "produit déboucheur" contenant de l'hydroxyde de sodium ou soude. L'hydroxyde de sodium transforme les graisses en savons qui se dissolvent alors dans l'eau.
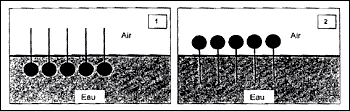
Le groupe caractéristique acide carboxylique est écrit en rouge : C17H33-COOH. Une chaine carbonée saturée à 17 atomes de carbone doit compter 36 atomes d'hydrogène ; or la chaîne carbonée C17H33 ne compte que 33 atomes d'hydrogène : donc la chaîne carbonée C17H33 est insaturée ( elle compte une double liaison carbone- carbone). C17H33-COO- en rouge, la chaîne carbonée représente la partie hydrophobe ; la partie hydrophile est écrite en bleu. La partie hydrophile ( disque noir) de l'ion est dans l'eau : le schéma (1) est correct. quantité de matière n1 d'oléate de sodium dissous dans l'eau. La masse molaire de l'oléate de sodium est M = 304 g.mol-1. n1 = m1 / M = 3,0 / 304 = 9,9 10-3 mol. L'hydroxyde de sodium transforme les graisses en savons qui se dissolvent alors dans l'eau. Cette réaction s'appelle la saponification ; elle est totale. La formule du butyrate de sodium est C3H7-COO-
+ Na+.
|
|||
|
|
||||
|
Masse molaires en g/mol : H = 1 ; C = 12 ; O = 16 ; N = 14 L'aspartame est un édulcorant possédant un pouvoir sucrant et qui est utilisé dans les boissons "light". La formule de l'aspartame est : 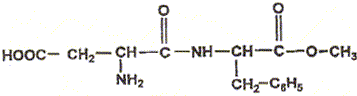
corrigé 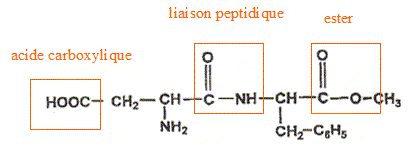
L'aspartame a pour formule brute C14H18O5N2, sa masse molaire est M = 14*12+18+5*16+2*14 =294 g/mol. La quantité de matière nasp d'aspartame contenue dans le litre de cette limonade vaut nasp =m/M= 0,60 / 294 = 2,0 10-3 mol. La concentration molaire c en aspartame de la boisson vaut c=nasp /V avec V= 1L d'où c=2,0 10-3 mol/L. les groupes fonctionnels caractéristiques des acides a -aminés:
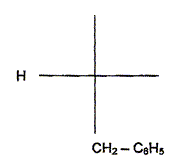
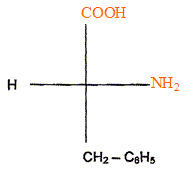
la configuration D de la phénylalanine en projection de Fischer.
|
||||
|
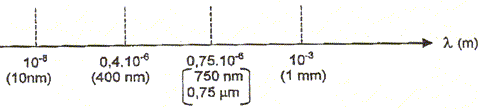
Données : Une onde électromagnétique est caractérisée par sa fréquence n ou sa longueur d'onde l dans le vide. Ces deux grandeurs sont liées par la relation : l =c/n où c est la célérité de la lumière dans le vide : c = 3,00 108 m/s. On donne la constante de Planck : h= 6,62 10-34 J.s
corrigé 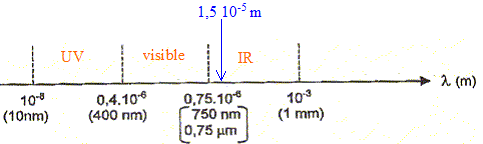
Une onde électromagnétique a une longueur d'onde dans le vide l = 1,5 10-5 m (15 mm). Elle appartient au domaine IR.
E =hc/l = 6,62 10-34*3 108 / 1,5 10-5 = 1,32 10-20 J. L'énergie E des photons s'exprime en fonction de la fréquence n de l'onde électromagnétique : d'une part E=h c/l et d'autre part l =c/n ; d'où E=hn .
La lumière solaire est une source de radiations UV ; effet biologique lié aux radiations ultraviolettes : mutagène et carcinogène , vieillissement de la peau. Radiations IR (Infrarouge)
|
||||
| |
||||
|
|
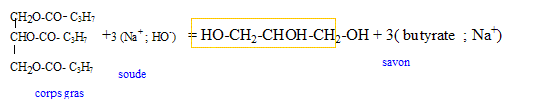
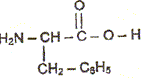 Compléter, après l'avoir recopiée, la
configuration D de la phénylalanine en projection de Fischer.
Compléter, après l'avoir recopiée, la
configuration D de la phénylalanine en projection de Fischer.