|
sans calculatrice |
|||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
" Diester est la contraction des mots Diesel et ester. Il est produit à partir de l'huile de colza, résultant de la trituration des graines de ce végétal. L'huile […] subit une transestérification par action du méthanol ; cette transformation peut être schématisée de la façon suivante : le trilinoléate de glycéryle de l'huile réagit avec le méthanol, il se forme du Diester et du glycérol. Les caractéristiques du Diester (qui est en fait un monoester méthylique) sont très proches de celles du gazole, de sorte qu'il peut être utilisé dans les voitures de tourisme mélangé au gazole à hauteur de 5% et jusqu'à 50% dans les moteurs plus puissants. L'ester d'huile de colza (ou Diester) est plus respectueux de l'environnement que le gazole seul, puisqu'il émet sensiblement moins de fumée et ne contient pratiquement pas de soufre. Le dioxyde de carbone rejeté lors de la combustion des biocarburants correspond à la quantité absorbée lors de la croissance des végétaux. Il n'augmente donc pas l'effet de serre. De plus, la présence d'oxygène dans les molécules de biocarburant améliore leur combustion et diminue le nombre des particules dues aux hydrocarbures imbrûlés, ainsi que le monoxyde de carbone. Cependant, une utilisation irraisonnée d'engrais entraînant une pollution des sols et des eaux peut contrebalancer le bilan écologique positif lié à la combustion des biocarburants. Mais le principal obstacle à sa généralisation est son coût qui ne peut le rendre compétitif sans subvention. " D'après document p.257 du livre scolaire NATHAN collection Tomasino TS chimie et site Web : www.hespul.org/biocarburant.html.
corrigé les fonctions caractéristiques de la molécule de trilinoléate de glycéryle : 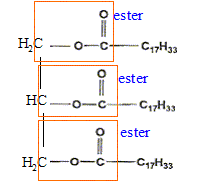
On veut synthétiser le Diester à partir d'un litre d'huile de colza en respectant les proportions stoechiométriques indiquées par l'équation. C57H98O6 + 3CH3-OH = C3H8O3 + 3 C19H34O2 Quantité de matière de trilinoléate de glycéryle contenue dans un litre d'huile de colza : 1L = 1000 mL ; masse (g) = volume (mL) * masse volumique ( g/mL) = 1000*0,82 = 820 g. quantité de matière (mol) = masse (g) / masse molaire (g/mol) = 820 / 878 = 0,93 mol. ( valeur plus précise 0,934 conservée pour les calculs suivants) Dans les conditions stoechiométriques, à partir de 0,934 mol de trilinoléate de glycéryle, il faut 3*0,934 = 2,80 mol de méthanol tableau descriptif de l'avancement de la transformation :
masse de méthanol (g) = quantité de matière (mol) * mase molaire (g/mol) = 2,8*32 = 89,6 g volume (mL) = masse (g) / masse volumique (g/mL) = 89,6 / 0,79
= 113 mL ( 1,1 102 mL) masse de Diester (g) = quantité de matière (mol) * masse molaire (g/mol) = 2,8*294 = 823,2 g ( 8,2 102 g) |
||||||||||||||||||||||||||||||||||||||||||||
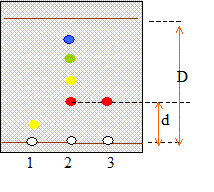
Étude d'un gazole : Chromatographie du gazole : pour vérifier la présence de Diester introduit dans un gazole, on réalise une chromatographie sur couche mince en utilisant un éluant approprié. Après révélation, on obtient le chromatogramme suivant :
Le gazol contient 4 espèces chimiques dont une est identifiable avec le Diester ( même rapport frontal d/D) ; le gazol ne contient pas detrilinoléate de glycéryle. Détermination de la teneur en Diester du gazole. Pour déterminer la teneur en biocarburant du gazole, on réalise dans un premier temps la saponification du Diester. On prélève une masse m = 1,00 g de gazole que l'on introduit dans un ballon. On ajoute alors un volume v = 20,0 mL d'éthanol et un volume vb = 25,0 mL de solution d'hydroxyde de potassium (K+ + HO-) de concentration molaire cb = 1,00 10-1 mol.L-1. Dans ces proportions, l'hydroxyde de potassium est en excès. On adapte sur le ballon un réfrigérant et on porte le mélange à ébullition douce sous agitation et sous hotte pendant une heure. l'équation de la réaction de saponification se produisant entre le Diester et les ions hydroxyde : C19H34O2 + HO- = C19H31O2-
+ CH3OH n(HO-)i = volume (L) * concentration
(mol/L = 25 10-3 * 0,1 = 2,50 10-3
mol. couples acide-base mis en présence : H3O+ / H2O et H2O / HO- d'où : H3O+ + HO- = 2 H2O. Définition de l'équivalence : A l'équivalence, la quantité de matière de l'espèce à titrer ( ion hydroxyde en excès) et la quantité de matière de l'espèce titrante ( acide chlorhydrique ) mis en présence ont réagi en proportions stoéchiométriques. Avant l'équivalence la solution à titrerd'ion hydroxyde est en excès dans le becher ; après l'équivalence la solution titrante d'acide chlorhydrique est en excès dans le bécher. quantité de matière, notée n(HO-)r, d'ions hydroxyde restants dans le ballon à la fin du chauffage et dosée par l'acide chlorhydrique : n(HO-)r = Ca EVa =0,1*14,8 10-3 = 1,48 10-3 mol. La quantité notée n(HO-)c, en ions hydroxyde consommés par la réaction de saponification est donnée par la relation : n(HO-)c = n(HO-)i - n(HO-)r. n(HO-)c = (2,5-1,48)10-3
= 1,02 10-3 mol. C19H34O2 + HO- = C19H31O2- + CH3OH d'après les nombres stoechiométriques de cette équation :
n(Diester) = n(HO-)c = 1,02 10-3 mol. m = n M = 1,02 10-3 * 294 = 0,30 g. la teneur (ou pourcentage massique) en Diester de ce gazole : 0,3 g de Diester dans 1 g de gazole. 0,3*100 = 30 %. Les avantages et les inconvénients de ce biocarburant : Avantages : respect de l'environnement ( émet moind de fumées, pas de soufre), ne contribue pas à l'effet de serre. Inconvénient : pollution des sols et des eaux ( engrais, fongicides utilisés en grand nombre en agriculture intensive) |
|||||||||||||||||||||||||||||||||||||||||||||
|
|
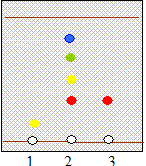 1 :
trilinoléate de glycéryle ; 2 gazol ; 3 : Diester
1 :
trilinoléate de glycéryle ; 2 gazol ; 3 : Diester