|
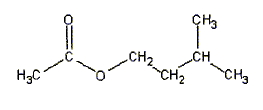
hydrolyse d'un ester : l'éthanoate de 3-méthylbutyl d'après bac S Polynésie 2006 |
||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||
|
|
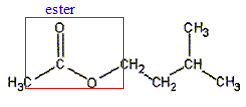
équation de la réaction associée à l'hydrolyse de l'ester : CH3-COO-CH2-CH2-CH(CH3)2 + H2O = CH3-COOH + (CH3)2CH-CH2-CH2OH CH3-COOH : acide éthanoïque ( groupe acide carboxilique -COOH) (CH3)2CH-CH2-CH2OH : 3-méthylbutan-1-ol ( alcool primaire groupe -CH2OH) équation associée à la réaction acido-basique de titrage : CH3-COOH + HO- = CH3-COO- + H2O Expression de la constante d'équilibre : K= [ CH3-COO-]éq / [HO- ]éq[CH3-COOH]éq ; Or CH3-COOH + H2O = CH3-COO- + H3O+ Ka = [ CH3-COO-]éq [H3O+ ]éq / [CH3-COOH]éq soit [ CH3-COO-]éq/ [CH3-COOH]éq = Ka /[H3O+ ]éq repport dans K : K = Ka /( [H3O+ ]éq [HO- ]éq) = Ka /Ke =1,8 10-5 / 10-14 = 1,8 109. équivalence : à l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiomètriques ; avant l'équivalence l'acide est en excès; après l'équivalence l'ion hydroxyde est en excès. Quantité de matière d'acide ( nA) présent à la date t : nA = CB VB éq. Quantité de matière d'acide ( n) formé dans le milieu initial à la date t : on a réparti le milieu réactionnel en 10 béchers d'où n = 10 nA = 10CB VB éq. caractéristiques d'une réaction d'hydrolyse : lente, athermique, limitée par la réaction inverse, l'estérification Quantités de matière initiales des réactifs : masse (g) = volume (mL) * masse volumique (g/mL) puis mase (g) / masse molaire (g/mol) n0 eau = 35*1/18 = 1,94 mol ; n0 ester = 15*0,87/130 =0,10 mol tableau d'avancement :
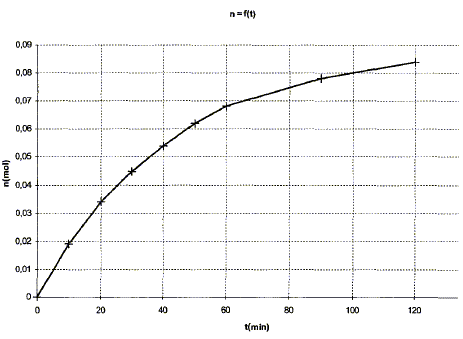
de plus xmax = 0,10 mol ( ester : réactif limitant) t1 = xf /xmax = 0,084/0,1 = 0,84 ( 84 %)
On peur augmentet t1 en éliminant l'un des réactif au fur et à mesure qu'il se forme (distillation par exemple quand cela est possible) on peut aussi ajouter l'un des réactifs ( le moins couteux : l'eau ) en grand excès : on déplace alors l'équilibre vers la droite, dans le sens de la consommation de ce réactif ajouté en large excès.
|
|||||||||||||||||||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||||||||||||||||||
|
|