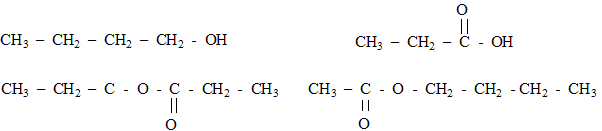|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
Pour sa création au printemps 2006, un illustre parfumeur décide d'utiliser l'odeur de pomme et celle de la banane, effluves de son nouveau parfum. Il choisit d'utiliser l'arôme naturel de pomme mais, pour des raisons économiques, de synthétiser une molécule à odeur de banane. Un parfum de pomme : Une des molécules présentes dans l'arôme naturel de pomme est un ester E de formule semi-développée : 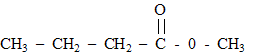
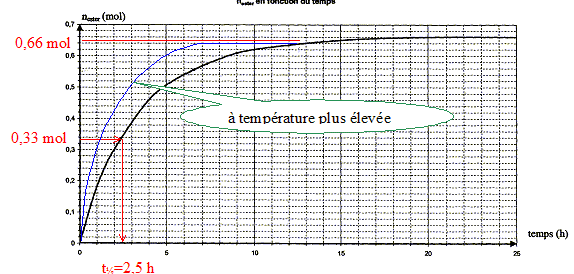
2. Un parfum de banane : L'ester à odeur de banane se nomme éthanoate d'isoamyle ou éthanoate de 3-méthylbutyle, en nomenclature officielle. Sa formule semi-développée est : 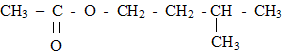 Le parfumeur décide de synthétiser cet ester, son extraction étant trop coûteuse. Il utilise alors un mélange d'acide éthanoïque et d'alcool isoamylique, de formules semi-développées respectives : CH3-COOH (acide éthanoïque) et (CH3)2- CH - CH2 - CH2 - OH (acide isoamylique) Avant de se lancer dans une production à grande échelle, le parfumeur décide de réaliser l'expérience. Pour cela, il introduit dans un erlenmeyer 1,00 mol d'acide éthanoïque et 1,00 mol d'alcool isoamylique. Le mélange est maintenu à température constante. Il prélève régulièrement un échantillon du mélange qu'il refroidit brutalement puis il dose l'acide restant par une solution d'hydroxyde de sodium. La quantité de matière d'acide est notée nA. Les résultats sont rassemblés dans le tableau ci-dessous :
nom de l'ester : butanoate de méthyle. les formules semi-développées de l'acide carboxylique et de l'alcool acide butanoïque CH3-CH2-CH2-COOH et le méthanol CH3OH l'équation associée à la réaction d'estérification : CH3-CH2-CH2-COOH + CH3OH = CH3-CH2-CH2-COO-CH3 + H2O éthanoate de butyle : CH3-COO-CH2-CH2-CH2-CH3.
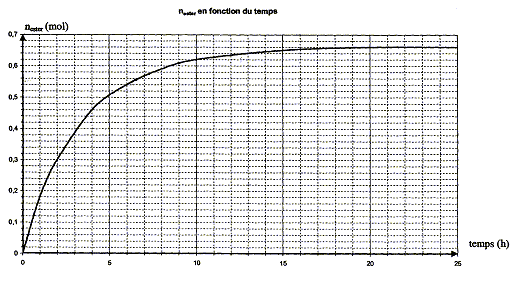
quantité de matière d'ester nester formée aux dates des prélèvements : nA = 1,00-x soit x = 1,00-nA ; nester = x =1,00-nA
au delà de t = 20 heures la composition du milieu réactionnel ne change plus ; un état d'équilibre chimique est atteint xf = nester f = 0,66 mol. taux d'avancement final t de la transformation : t = xf /xmax = 0,66 / 1 = 0,66 ( 66 %). t <1 donc cette transformation
n'est pas totale : elle est limitée par la réaction inverse,
l'hydrolyse de l'ester. en utilisant un excès de l'un des réactifs ( le moins couteux), on déplace l'équilibre dans le sens direct, formation de l'ester. éliminer l'un des produits au fur et à mesure qu'il se forme ( le plus volatil, par distillation si cela est possible) interprétation qualitative de la variation de la vitesse de réaction au cours du temps : à une date donnée t, la vitesse volumique est proportionnelle à [dx/dt]t ; c'est à dire au coefficient directeur de la tangente à la courbe nester = f(t) à la date t. Or au cours du temps, les tangentes à cette courbe sont de plus en plus inclinées sur l'horizontale : la vitesse volumique diminue : cela est du à la diminution des concentrations ( facteur cinétique) des réactifs. temps de demi-réaction t1/2 : durée au bout de laquelle l'avancement x est égal à la moitié de l'avancement final ( dans ce cas xt½=0,33 mol)
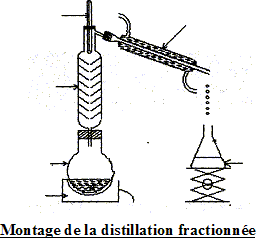
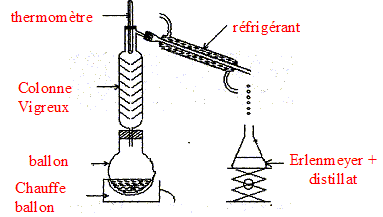
but du refroidissement brutal effectué avant chaque dosage : blocage cinétique de l'estérification.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||