|
|
||||
|
||||
|
|
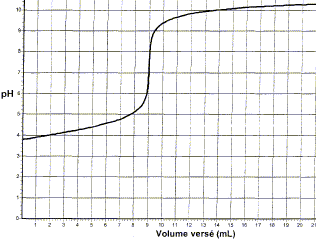
On désire déterminer la teneur en acide ascorbique C6H8O6 d'une solution. On envisage deux méthode de dosage, reposant l'une sur le caractère acide de la molécule et, l'autre, sur son caractère réducteur. Masse atomique molaire (g/mol) : C : 12 ; H : 1 ; O : 16 . couples oxydant réducteur : C6H6O6 / C6H8O6 ; I2/ I- ; S4O62-/ S2O32-. couple acide base : C6H8O6 /C6H7O6 -. I- Dosage acido-basique de la solution d'acide ascorbique : On réalise un dosage pHmétrique de 10,0 mL de la solution d'acide ascorbique par une solution d'hydroxyde de sodium ou soude de concentration molaire Cb=5,0 10-4 mol/L.
II- Dosage par oxydoréduction de la solution d'acide ascorbique. étape 1 : l'acide ascorbique et oxydé par une solution de diiode I2 en excès : on verse dans un erlenmeyer un volume V1=10,0 mL de la solution d'acide ascorbique auquel on ajoute un volume V2=20,0 d'une solution de diiode de concentration C2=1,0 10-3 mol/L. étape 2 : dosage du diiode en excès. Le diiode en excès est alors dosé par une solution de thiosulfate de sodium( 2Na+aq +S2O32-aq) de concentration C3=2,4 10-3 mol/L en présence d'empois d'amidon ou de thiodène. Le volume versé à l'équivalence est VE=12,9 mL.
III- Conclusion.
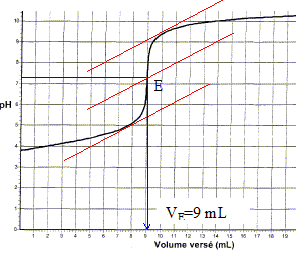
Equation de la réaction de dosage : C6H8O6 + HO- = C6H7O6- +H2O définition de l'équivalence : A l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoechiomètriques. Dans le bécher, avant l'équivalence l'acide ascorbique est en excès ; après l'équivalence la soude est en escès. Détermination du volume VE:
Relation entre les quantités de matière à l'équivalence : CbVE=CaVa d'où Ca=CbVE/Va=5 10-4*9/10=4,5 10-4 mol/L verrerie utilisée pour prélever les volumes des réactifs ( étape 1) : pipette jaugée 10,0 et 20,0 mL + pipeteur quantité de matière initiale I2 (étape 1) : nI2 initial = V2C2 =0,02*10-3 = 2,0 10-5 mol équation de la réaction d'oxydoréduction ( étape 1) : C6H8O6 =C6H6O6 + 2H++2e- oxydation I2+2e- = 2I- réduction C6H8O6 +I2=C6H6O6 + 2H++2I- équation de la réaction d'oxydoréduction ( étape 2) : I2+2e- = 2I- réduction 2S2O32- = S4O62- +2e- oxydation 2S2O32- +I2= S4O62- + 2I- quantité de matière I2 en excès (étape 2) : d'après les coefficients stochiomètriques de l'équation (étape 2) : nI2excès=½nthiosulfate = ½ =½C3VE. quantité de matière I2 réagissant avec l'acide ascorbique ( étape 1) : nI2 initial - nI2 excès=V2C2-½C3VE. d'après les coefficients stochiomètriques de l'équation (étape 1) : nI2 = nacide ascorbique= V2C2-½C3VE. concentration molaire acide ascorbique : nacide ascorbique / V1 = (0,02*10-3 -0,5*2,4 10-3*12,9 10-3)/0,01 =4,52 10-4 mol/L (4,5 10-4 mol/L) résultat identique à celui donné par le dosage pHmétrique. concentration massique en acide ascorbique : masse molaire acide ascorbique (g/mol) * concentration molaire (mol/L)= M= 6*12+8+6*16 =176 g/mol ; t= 196*4,52 10-4 = 8,0 10-2 g/L.
|
|||
|
|