|
sans calculatrice |
|||||||||||||||||||||
|
|||||||||||||||||||||
|
|
L'aquariophilie est une passion qui touche de plus en plus d'amateurs mais aussi de néophytes. De nombreux facteurs peuvent contribuer à un déséquilibre dangereux pour la vie et la santé des poissons. Il est donc nécessaire de contrôler régulièrement la qualité de l'eau. Le pH de l'eau est la première grandeur qu'il faut mesurer, au moins une fois par semaine, et ajuster éventuellement. En effet, certains poissons ne peuvent évoluer que dans un milieu acide (c'est le cas des poissons d'Amazonie comme les Néons ou les Tétras), d'autres dans un milieu basique (c'est le cas des poissons d'Amérique Centrale comme les Platy et les Molly). Aucun de ces poissons ne tolère une trop forte teneur en ions ammonium (NH4+) ou en ions nitrite (NO2-) : le cycle de l'azote doit donc être surveillé en évitant soigneusement la surpopulation de l'aquarium et l'excès de nourriture. D'après "Poissons et aquariums" - Édition Larousse L'exercice suivant est destiné à préciser certains points de ce texte. On étudie d'abord un produit commercial utilisé pour diminuer le pH de l'eau de l'aquarium ; on s'intéresse ensuite à la formation des ions ammonium. Les parties 1. et 2. sont indépendantes. I- Étude d'une solution commerciale destinée à diminuer le pH de l'aquarium : Sur l'étiquette du produit on peut lire que la solution commerciale S0 est constituée d'acide chlorhydrique (H3O+ + Cl - (aq)) mais aucune concentration n'est indiquée. La transformation conduisant à l'acide chlorhydrique étant totale, la concentration c0 de la solution commerciale est égale à la concentration en ions H3O+. On cherche à déterminer cette concentration en faisant un titrage pH-métrique. Pour cela on dilue 50 fois la solution commerciale et on procède au titrage d'un volume VA = 20,0 mL de la solution diluée SA à l'aide d'une solution d'hydroxyde de sodium SB (Na+(aq) + HO - (aq)) de concentration molaire en soluté apporté cB = 4,0 10 -2 mol.L-1. On obtient la courbe ci-dessous. On a également fait apparaître la courbe représentant la dérivée du pH en fonction du volume de soude versé. 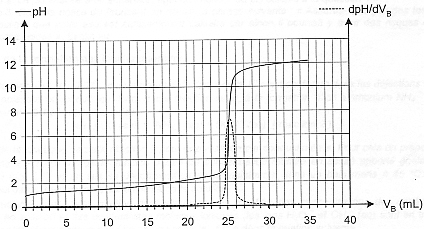 Aide au calcul : log 8= 0,9; log 5 = 0,7; 106,4 = 2,5 105 ; 10 -6,4 = 4,0 10 - 7
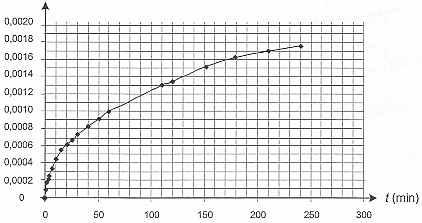
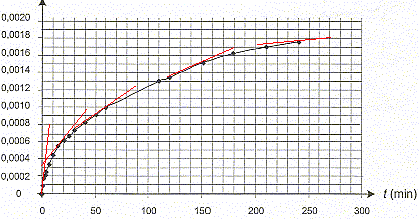
II- Étude de la formation des ions ammonium. L'urée, de formule (NH2)2CO, est un polluant de l'aquarium. Elle est contenue dans les déjections de certains poissons et conduit, au cours d'une réaction lente, à la formation d'ions ammonium NH4+ et d'ions cyanate OCN- selon l'équation : (NH2)2CO (aq) = NH4+ (aq) + OCN- (aq) (réaction 2) L'étude de la cinétique de cette réaction 2 peut être réalisée par conductimétrie. Pour cela on prépare un volume V = 100,0 mL d'une solution d'urée de concentration molaire en soluté apporté égale à c = 0,20 mol.L-1 et on suit sa décomposition en la maintenant dans un bain marie à 45 °C. À différentes dates, on mesure la conductivité de la solution. La conductivité s de cette solution peut s'exprimer en fonction des concentrations des espèces ioniques en solution et des conductivités molaires ioniques (les ions H3O+ et HO- (aq) sont en très faible quantité et pourront ne pas être pris en compte). On a donc la relation suivante : s = lNH4+[NH4+] + lOCN-[OCN-]
corrigé Equation de la réaction support du titrage : couples acide-base mis en présence : H3O+ / H2O et H2O / HO- d'où : H3O+ + HO- = 2 H2O. Définition de l'équivalence : A l'équivalence, la quantité de matière de l'espèce à titrer ( acide chlorhydrique) et la quantité de matière de l'espèce titrante ( hydroxyde de sodium ) mis en présence ont réagi en proportions stoéchiométriques. Avant l'équivalence la solution à titrer d'acide chlorhydrique est en excès dans le becher ; après l'équivalence la solution titrante de soude est en excès dans le bécher. Concentration des ions oxonium dans la solution diluée SA : Vb E = 25 mL ( lecture graphe ) Ca = CbVb E / Va = 0,04*25 / 20 = 0,050 mol/L. Or la solution commerciale a été diluée 50 fois : la concentration des ions oxonium [H3O+] dans cette solution est voisine de 0,05*50 = 2,5 mol.L-1 . La valeur du pH final de l'eau de l'aquarium s'il n'y avait qu'une simple dilution des ions H3O+ Sur le mode d'emploi du fabricant on peut lire qu'il faut verser, en une fois, 20 mL de la solution commerciale dans 100 L d'eau. Pour simplifier le calcul, on considérera que le volume final reste égal à 100 L. Quantité de matière d'ion oxonium dans 20 mL de la solution commerciale = concentration (mol/L) * volume (L) = 2,5*0,02 = 0,05 mol concentration en ion oxonium dans l'aquarium : quantité de matière (mol) / volume (L) = 0,05/100 = 5 10-4 mol/L pH final : -log (5 10-4 ) = -0,7 + 4 = 3,3. Expression de la constante d'équilibre K1 associée à l'équation de la réaction 1 : HCO3-(aq) + H3O+ = CO2 (aq) + 2 H2O (l ) ( réaction 1 ) K1 = [CO2 (aq)] / ([HCO3-(aq)][H3O+ (aq) ]) De plus la constante d'acidité KA du couple CO2(aq),
H2O / HCO3-(aq) s'écrit : Or le quotient de réaction initial de cette réaction vaut :
Qr,i = 5,0, valeur inférieure à K1 : le critère
d'évolution spontanée indique une évolution spontannée du système dans
le sens direct ; de plus K1 est très grande, en conséquence,
les ions H3O+ sont consommés si l'eau est
calcaire et le pH final sera supérieur au pH calculé à la question 1.3. Dans une eau, très peu calcaire, la concentration molaire initiale HCO3-(aq) est très faible ; or celui-ci intervient au dénominateur de Qr,i ; Qr, i sera donc d'autant plus grand , voir supérieur à K1 : en conséquence peu ou pas d'ions oxonium seront consommés par la réaction 1 et le pH de l'eau de l'aquarium sera acide. Étude de la formation des ions ammonium. (NH2)2CO (aq) = NH4+ (aq) + OCN- (aq) (réaction 2) La concentration de la solution en ions NH4+ (aq) : D'une part, d'après les coefficients stoechiométriques de la réaction 2, les quantités de matière d'ionsNH4+ (aq) et OCN- (aq) sont égales, soit encore : [NH4+ (aq)] = [OCN- (aq) ]. D'autre part : s = lNH4+[NH4+] + lOCN-[OCN-] D'où s =( lNH4++ lOCN-)[NH4+] ; [NH4+] = s /( lNH4++ lOCN-) Le tableau descriptif de l'évolution du système :
Concentration en ions NH4+ (aq)= x / V = x/0,1 = 10 x Le taux d'avancement de la réaction à l'instant de date t = 110 min : d'après le graphe xt=110 = 0,0013 mol ; t = x/ xmax = 0,0013/0,02 = 6,5 10-2. En utilisant la courbe précédente, l'évolution de cette vitesse :
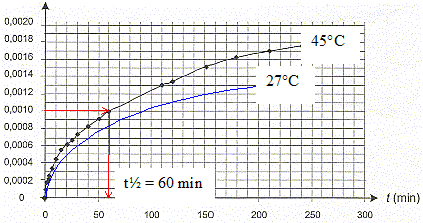
[dx/dt]t correspond au coefficient directeur de la tangente à la courbe à la date t ; la vitesse de la réaction est proportionnelle à [dx/dt]t Or les tangentes sont de plus en plus inclinées par rapport à l'horizontale : en conséquence [dx/dt]t et donc la vitesse diminuent au cours du temps. Le taux d'avancement final de cette transformation : En poursuivant l'expérience pendant une durée suffisante, on obtient une concentration finale : [NH4+]f = 2,0 10 -2 mol.L-1 xf = [NH4+]f * V = 0,02*0,1 = 2,0 10-3 mol. t = xf/ xmax =2,0 10-3/ 0,02 = 0,10 , valeur très inférieure à 1, la transformation est donc limitée. Le temps de demi-réaction : Durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final soit x½ = 0,001 mol.
Les ions ammonium finissent par se transformer en ions nitrate dont l'accumulation risque de compromettre la vie des poissons. Ces derniers ions constituent un aliment essentiel pour les plantes vertes de l'aquarium. Expliquer pourquoi dans les livres d'aquariophilie, on dit que l'aquarium doit être "bien planté". La présence de nombreuses plantes dans l'aquarium consomme les ions nitrates : en conséquence, ces derniers ne peuvent pas s'accumuler et la vie des poissons n'est pas compromise.
|
||||||||||||||||||||
|
|
|||||||||||||||||||||
|
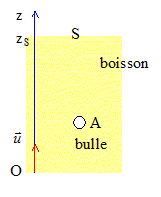
On se propose dans cet exercice de faire une plongée au cœur de l'effervescence d'une boisson gazeuse, d'illustrer et d'interpréter sous l'angle physico-chimique les différentes étapes de la vie éphémère d'une bulle, à savoir : sa naissance, son ascension dans le liquide, et son éclatement en surface. Dans tout l'exercice les bulles seront assimilées à des sphères, et la boisson à un liquide de masse volumique égale à celle de l'eau. Le référentiel d'étude est terrestre considéré comme galiléen. Masses volumiques : eau re = 1,0103 kg.m-3; dioxyde de carbone rCO2 = 1,8 kg.m-3 ; Intensité de la pesanteur: g = 10 m.s-2. I- Naissance et décollement d'une bulle : Dans une bouteille fermée de boisson gazeuse, un équilibre s'établit entre le dioxyde de carbone qui est dissous dans la boisson et le dioxyde de carbone gazeux piégé dans le col de la bouteille. Lors de l'ouverture de celle-ci, l'équilibre est rompu et la boisson se débarrasse d'une partie du dioxyde de carbone dissous qui retourne progressivement en phase gazeuse. Il y a formation de bulles qui vont s'enrichir continûment en gaz au cours de leur remontée. Dans un verre, les bulles naissent sur des sites de nucléation qui sont des embryons de bulles présents en solution ou de petites poches d'air piégées par des impuretés microscopiques (fibres de cellulose, microcristaux …). La figure 1 illustre cette formation de bulles sur un site de nucléation. Dès que la valeur de la poussée d'Archimède à laquelle la bulle est soumise dépasse la valeur de la force capillaire qui l'ancre à son site de nucléation, la bulle se détache. Puis une autre bulle naît et subit le même sort. 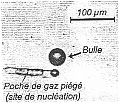 Pour une bulle qui vient de se détacher du site de nucléation dans un liquide de masse volumique re :
II- Ascension d'une bulle : à la recherche d'une modélisation satisfaisante.
III- L'éclatement des bulles en surface : La bulle a maintenant gagné la surface et le film liquide qui constitue la partie émergée de la bulle s'amincit (figure 4.a) jusqu'à se rompre lorsque son épaisseur avoisine le micromètre. Le trou qui apparaît s'ouvre (figure 4.b) et la durée de disparition de la calotte sphérique n'est que de quelques dizaines de microsecondes ! Le cratère qui reste à la surface du liquide ne va pas durer (figure 4.c). 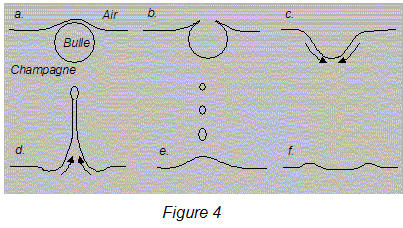 De violents courants apparaissent et, en se refermant, cette cavité projette vers le haut un mince jet de liquide (figure 4.d). Le jet se brise ensuite en fines gouttelettes (figure 4.e) qui en retombant dans le liquide engendrent des ondes circulaires centrées sur la "bulle-mère" (figure 4.f). Ces observations nécessitent l'utilisation d'une caméra ultra-rapide capable de filmer jusqu'à 2000 images par seconde avec une résolution proche du micromètre.
Bien qu'éphémère, la vie d'une bulle n'en est pas moins riche en événements ! corrigé La poussée d'Archimède qui s'exerce sur une bulle de volume V0 dans la boisson : direction verticale ; sens : vers le haut. Expression littérale de sa valeur en fonction du volume V0 de la bulle : poids du voume d'eau déplacé soit V0re g. Étude du mouvement d'une bulle en l'absence de force de frottement : valeur du poids P0 de la bulle : V0 rCo2 g ; valeur de la poussée d'Archimède FA =V0re g. le rapport : P0 / FA : rCo2 / re = 1,8 10-3. Le poids est environ 500 fois plus petit que la poussée
d'Archimède : P0 négligeable devant FA. La bulle n'est soumise qu'à la poussée d'Archimède, verticale, vers le haut, valeur : V0re g. La seconde loi de Newton s'écrit : m az = V0re g avec m = V0 rCo2 az = re/
rCo2 g
. La vitesse est une primitive de l'accélération ; de plus la vitesse initiale est nulle v = az t = re/
rCo2 g t vS=15 10-2 m/s ; tS= vSrCo2 / (reg) = 15 10-2
*1,8 / 104 = 29 10-6 s = 29 ms. Etude du mouvement de la bulle en présence d'une force de frottement : Le liquide exerce sur la bulle une force de frottement, proportionnelle à sa vitesse, de valeur f = k v,, colinéaire et de sens contraire au vecteur vitesse. k est un coefficient qui dépend du rayon de la bulle et de la viscosité du fluide dans lequel elle se déplace. 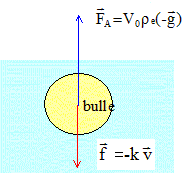 En appliquant la deuxième loi de Newton, l'équation différentielle qui régit l'évolution de la vitesse de la bulle s'écrit alors : mdv/dt =V0re g -kv avec m = V0 rCo2 V0 rCo2dv/dt
+ kv = V0re
g Lorsque la vitesse limite est atteinte, le mouvement de la bulle est rectiligne uniforme : vlim = constante et donc dvlim/dt = 0. l'équation différentielle s'écrit alors : kvlim/(rCO2 V0) =re /rCO2 g vlim =re
g V0 / k Pourquoi le volume de la bulle augmente si fortement lors de sa remontée ? D'après le texte :" Il y a formation de bulles qui vont s'enrichir continûment en gaz au cours de leur remontée" La quantité de matière n0 de gaz présent dans la bulle augmente. En assimilant le paz à un gaz parfait ( à température constante et à pression variant seulement de 2%), le volume de la bulle est proportionnel à la quantité de matière n0 et en conséquence, ce volume augmente au cours de la remontée. Influence de la variation du volume de la bulle sur
chacune des forces qui s'exercent sur elle au cours de la remontée : La poussée d'Archimède, de valeur V0re g, est proportionnelle au volume de la bulle ; donc la poussée d'Archimède augmente avec V0 Le coefficient k augmente avec le rayon de la bulle, donc la force de frotement de valeur kv, augmente avec V0. La bulle a maintenant gagné la surface et le film liquide qui constitue la partie émergée de la bulle s'amincit (figure 4.a) jusqu'à se rompre lorsque son épaisseur avoisine le micromètre. Le trou qui apparaît s'ouvre (figure 4.b) et la durée de disparition de la calotte sphérique n'est que de quelques dizaines de microsecondes. Ces observations nécessitent l'utilisation d'une caméra ultra-rapide capable de filmer jusqu'à 2000 images par seconde avec une résolution proche du micromètre : la durée entre deux images est de l'ordre de 1/2000 = 5 10-4 s = 500 ms, valeur très grande devant la durée de disparition de la calotte sphérique : on ne peut donc pas obtenir d'images du film liquide en train de se rompre. L'onde circulaire créée est transversale : la direction de propagation de l'onde est perpendiculaire à la déformation du milieu liquide.
|
|||||||||||||||||||||
|
Le but de cet exercice est d'étudier les réactions nucléaires
qui se produisent dans l'univers, notamment dans les étoiles, et qui
engendrent la synthèse des éléments chimiques. I- Les premiers éléments présents dans l'univers : Selon le modèle du big-bang, quelques secondes après l'explosion originelle, les seuls éléments chimiques présents étaient l'hydrogène (90%), l'hélium et le lithium, ce dernier en quantité très faible. Les physiciens ont cherché à comprendre d'où provenaient les autres éléments existant dans l'univers.
II- Fusion de l'hydrogène : Sous l'action de la force gravitationnelle les premiers éléments (hydrogène, hélium…) se rassemblent, formant des nuages gazeux en certains endroits de l'univers. Puis le nuage s'effondre sur lui-même et la température centrale atteint environ 107 K. A cette température démarre la première réaction de fusion de l'hydrogène dont le bilan peut s'écrire : 4 11H -->42He + 2 01e . Une étoile est née.
III- Un produit de la fusion de l'hélium : D'autres réactions de nucléosynthèse peuvent se produire au cœur d'une étoile. Selon les modèles élaborés par les physiciens, l'accumulation par gravitation des noyaux d'hélium formés entraîne une contraction du cœur de l'étoile et une élévation de sa température. Lorsqu'elle atteint environ 10 8 K, la fusion de l'hélium commence : 42He +42He -->84Be . Il se forme ainsi des noyaux de "béryllium 8" radioactifs de très courte durée de vie. On s'intéresse à la radioactivité du "béryllium 8". Soit N(t) le nombre de noyaux de "béryllium 8" présents dans l'échantillon à l'instant de date t, et N0 celui à l'instant de date t0 = 0 s.
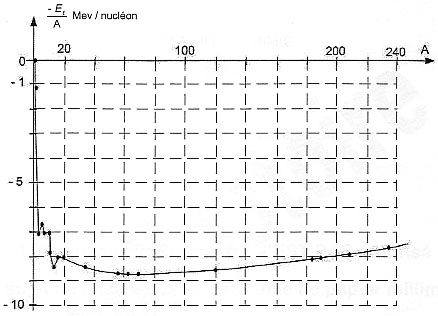
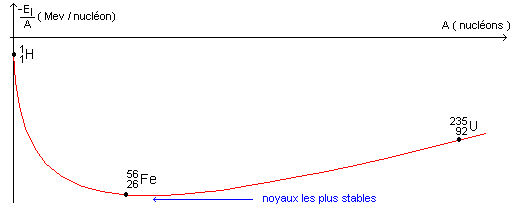
IV- Vers des éléments plus lourds : Dans les étoiles de masse au moins 4 fois supérieure à celle du Soleil, d'autres éléments plus lourds peuvent ensuite être formés par fusion, par exemple le carbone 12 C, l'oxygène 16O, le magnésium 24Mg, le soufre 32S (…) et le fer 56Fe.
V- L'élément fer : Dans certaines étoiles, à la fin de la période des fusions, une explosion se produit libérant de l'énergie. Des noyaux de fer 5626Fe sont dissociés et d'autres sont recréés par désintégration radioactive des noyaux de cobalt 5627Co . Les noyaux de fer, formés dans un état excité, émettent alors des rayonnements d'énergie bien déterminée, tels que le satellite SMM a pu en détecter en 1987 en observant une supernova dans le nuage de Magellan.
Aide aux calculs : 6,63 / (3*1,238 = 1,8 ; 1,238/(6,63*3) = 2,7 ; 3*6,63/1,238 = 16 corrigé Composition des noyaux des atomes d'hélium 42He et 32He ainsi que celle de l'ion hélium 42He2+ : 42He : 2 protons et 4-2 = 2 neutrons ; 32He : 2 protons et 3-2 = 1 neutron ; 42He2+ : 2 protons et 4-2 = 2 neutrons. La synthèse des éléments chimiques plus lourds se fait par des réactions nucléaires dans lesquelles la composition du noyau est modifiée. Une réaction chimique met en jeu quelques électrons externes, sans modifier la structure du noyau. 4 11H -->42He + 2 01e. Expression littérale de l'énergie |DE| libérée lors de cette réaction de fusion des 4 noyaux d'hydrogène. variation de masse |Dm|= mHe +2me -4 mP ; |DE| = |Dm| c² = (mHe +2me -4 mP) c² = 4 10 -12 J Cas du Soleil : Or la fusion de 4 noyaux d'hydrogène, soit d'une masse de 4*1,67 10-27 kg d'hydrogène, libère 4 10 -12 J. L'énergie totale ET pouvant être produite par ces réactions de fusion est voisine de : 4 10 -12 *2 1029 /(4*1,67
10-27) = 2 / 1,67 10 44 J =1,2 1044
J. 1044 / 1034 = 1010 ans. 42He +42He -->84Be . On s'intéresse à la radioactivité du "béryllium 8". Soit N(t) le nombre de noyaux de "béryllium 8" présents dans l'échantillon à l'instant de date t, et N0 celui à l'instant de date t0 = 0 s. La loi de décroissance radioactive s'écrit : N(t) = N0 exp(-lt) ou encore ln (N0 / N(t) = lt. à t½ , N(t½) = ½N0 d'où : ln2 = l t1/2 . Calculer le temps de demi-vie t1/2 du "béryllium 8": t1/2 = ln2 / l avec la constante radioactive du "béryllium 8", l = 1 1016 s-1 t1/2 = 0,7 / 1016 = 7 10-17 s. Valeur du rapport N(t1)/N0 à l'instant de date t1 = 1,4 10 -16 s ln (N0 / N(t1) = lt1 = 1016 *1,4 10 -16 = 1,4 = 2*0,7 = ln2² d'où N0 / N(t1) = 4. Expression littérale de l'énergie de liaison par nucléon El/A d'un noyau de fer 5626Fe , en fonction des masses du neutron mn, du proton mp, du noyau de "fer 56" mFe et de la célérité de la lumière dans le vide c. On appelle énergie de liaison notée El d'un noyau l'énergie que doit fournir le milieu extérieur pour séparer ce noyau au repos en ses nucléons libres au repos. 5626Fe compte 26 protons et 56-26 = 30 neutrons. El = |mFe- 26mp - 30mn | c² El/A =|mFe- 26mp - 30mn
| c² / 56. Lors de la désintégration radioactive du noyau de cobalt 5627Co il se forme, en plus du fer 5626Fe, une autre particule. L'équation de cette désintégration s'écrit : 5627Co --> 5626Fe* + 01e ( positrons) suivi de la désexitation du noyau de fer : 5626Fe* ---> 5626Fe + 00g. ( photon ) Ce rayonnement a une énergie bien déterminée : en conséquence les niveaux d'énergie du noyau de fer sont quantifiés. E= 1238 keV = 1,238 106 eV Exprimer cette énergie en joule : 1,238 106 *1,6 10-19 = 1,238*1,6 10-13 J De plus E = hn = hc/l soit l = hc/E = 6,63 10-34 * 3 108 /(1,238*1,6 10-13)= [6,63*3/1,238] / 1,6 10-13 =16/1,6 10-13 = 10-12 m
|
|||||||||||||||||||||
| |
|||||||||||||||||||||
|
|