|
sans calculatrice |
|||||||||||||||||||||||
|
|||||||||||||||||||||||
|
|
L'aquariophilie est une passion qui touche de plus en plus d'amateurs mais aussi de néophytes. De nombreux facteurs peuvent contribuer à un déséquilibre dangereux pour la vie et la santé des poissons. Il est donc nécessaire de contrôler régulièrement la qualité de l'eau. Le pH de l'eau est la première grandeur qu'il faut mesurer, au moins une fois par semaine, et ajuster éventuellement. En effet, certains poissons ne peuvent évoluer que dans un milieu acide (c'est le cas des poissons d'Amazonie comme les Néons ou les Tétras), d'autres dans un milieu basique (c'est le cas des poissons d'Amérique Centrale comme les Platy et les Molly). Aucun de ces poissons ne tolère une trop forte teneur en ions ammonium (NH4+) ou en ions nitrite (NO2-) : le cycle de l'azote doit donc être surveillé en évitant soigneusement la surpopulation de l'aquarium et l'excès de nourriture. D'après "Poissons et aquariums" - Édition Larousse L'exercice suivant est destiné à préciser certains points de ce texte. On étudie d'abord un produit commercial utilisé pour diminuer le pH de l'eau de l'aquarium ; on s'intéresse ensuite à la formation des ions ammonium. Les parties 1. et 2. sont indépendantes. I- Étude d'une solution commerciale destinée à diminuer le pH de l'aquarium : Sur l'étiquette du produit on peut lire que la solution commerciale S0 est constituée d'acide chlorhydrique (H3O+ + Cl - (aq)) mais aucune concentration n'est indiquée. La transformation conduisant à l'acide chlorhydrique étant totale, la concentration c0 de la solution commerciale est égale à la concentration en ions H3O+. On cherche à déterminer cette concentration en faisant un titrage pH-métrique. Pour cela on dilue 50 fois la solution commerciale et on procède au titrage d'un volume VA = 20,0 mL de la solution diluée SA à l'aide d'une solution d'hydroxyde de sodium SB (Na+(aq) + HO - (aq)) de concentration molaire en soluté apporté cB = 4,0 10 -2 mol.L-1. On obtient la courbe ci-dessous. On a également fait apparaître la courbe représentant la dérivée du pH en fonction du volume de soude versé. 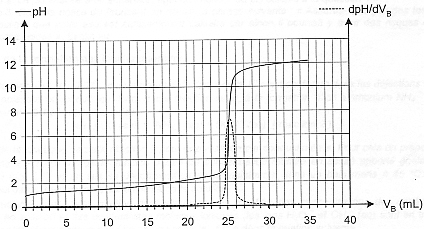 Aide au calcul : log 8= 0,9; log 5 = 0,7; 106,4 = 2,5 105 ; 10 -6,4 = 4,0 10 - 7
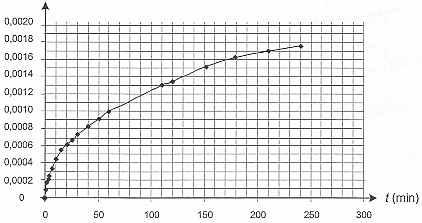
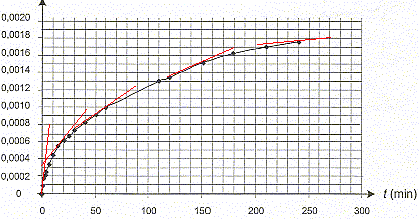
II- Étude de la formation des ions ammonium. L'urée, de formule (NH2)2CO, est un polluant de l'aquarium. Elle est contenue dans les déjections de certains poissons et conduit, au cours d'une réaction lente, à la formation d'ions ammonium NH4+ et d'ions cyanate OCN- selon l'équation : (NH2)2CO (aq) = NH4+ (aq) + OCN- (aq) (réaction 2) L'étude de la cinétique de cette réaction 2 peut être réalisée par conductimétrie. Pour cela on prépare un volume V = 100,0 mL d'une solution d'urée de concentration molaire en soluté apporté égale à c = 0,20 mol.L-1 et on suit sa décomposition en la maintenant dans un bain marie à 45 °C. À différentes dates, on mesure la conductivité de la solution. La conductivité s de cette solution peut s'exprimer en fonction des concentrations des espèces ioniques en solution et des conductivités molaires ioniques (les ions H3O+ et HO- (aq) sont en très faible quantité et pourront ne pas être pris en compte). On a donc la relation suivante : s = lNH4+[NH4+] + lOCN-[OCN-]
corrigé Equation de la réaction support du titrage : couples acide-base mis en présence : H3O+ / H2O et H2O / HO- d'où : H3O+ + HO- = 2 H2O. Définition de l'équivalence : A l'équivalence, la quantité de matière de l'espèce à titrer ( acide chlorhydrique) et la quantité de matière de l'espèce titrante ( hydroxyde de sodium ) mis en présence ont réagi en proportions stoéchiométriques. Avant l'équivalence la solution à titrer d'acide chlorhydrique est en excès dans le becher ; après l'équivalence la solution titrante de soude est en excès dans le bécher. Concentration des ions oxonium dans la solution diluée SA : Vb E = 25 mL ( lecture graphe ) Ca = CbVb E / Va = 0,04*25 / 20 = 0,050 mol/L. Or la solution commerciale a été diluée 50 fois : la concentration des ions oxonium [H3O+] dans cette solution est voisine de 0,05*50 = 2,5 mol.L-1 . La valeur du pH final de l'eau de l'aquarium s'il n'y avait qu'une simple dilution des ions H3O+ Sur le mode d'emploi du fabricant on peut lire qu'il faut verser, en une fois, 20 mL de la solution commerciale dans 100 L d'eau. Pour simplifier le calcul, on considérera que le volume final reste égal à 100 L. Quantité de matière d'ion oxonium dans 20 mL de la solution commerciale = concentration (mol/L) * volume (L) = 2,5*0,02 = 0,05 mol concentration en ion oxonium dans l'aquarium : quantité de matière (mol) / volume (L) = 0,05/100 = 5 10-4 mol/L pH final : -log (5 10-4 ) = -0,7 + 4 = 3,3. Expression de la constante d'équilibre K1 associée à l'équation de la réaction 1 : HCO3-(aq) + H3O+ = CO2 (aq) + 2 H2O (l ) ( réaction 1 ) K1 = [CO2 (aq)] / ([HCO3-(aq)][H3O+ (aq) ]) De plus la constante d'acidité KA du couple CO2(aq),
H2O / HCO3-(aq) s'écrit : Or le quotient de réaction initial de cette réaction vaut :
Qr,i = 5,0, valeur inférieure à K1 : le critère
d'évolution spontanée indique une évolution spontannée du système dans
le sens direct ; de plus K1 est très grande, en conséquence,
les ions H3O+ sont consommés si l'eau est
calcaire et le pH final sera supérieur au pH calculé à la question 1.3. Dans une eau, très peu calcaire, la concentration molaire initiale HCO3-(aq) est très faible ; or celui-ci intervient au dénominateur de Qr,i ; Qr, i sera donc d'autant plus grand , voir supérieur à K1 : en conséquence peu ou pas d'ions oxonium seront consommés par la réaction 1 et le pH de l'eau de l'aquarium sera acide. Étude de la formation des ions ammonium. (NH2)2CO (aq) = NH4+ (aq) + OCN- (aq) (réaction 2) La concentration de la solution en ions NH4+ (aq) : D'une part, d'après les coefficients stoechiométriques de la réaction 2, les quantités de matière d'ionsNH4+ (aq) et OCN- (aq) sont égales, soit encore : [NH4+ (aq)] = [OCN- (aq) ]. D'autre part : s = lNH4+[NH4+] + lOCN-[OCN-] D'où s =( lNH4++ lOCN-)[NH4+] ; [NH4+] = s /( lNH4++ lOCN-) Le tableau descriptif de l'évolution du système :
Concentration en ions NH4+ (aq)= x / V = x/0,1 = 10 x Le taux d'avancement de la réaction à l'instant de date t = 110 min : d'après le graphe xt=110 = 0,0013 mol ; t = x/ xmax = 0,0013/0,02 = 6,5 10-2. En utilisant la courbe précédente, l'évolution de cette vitesse :
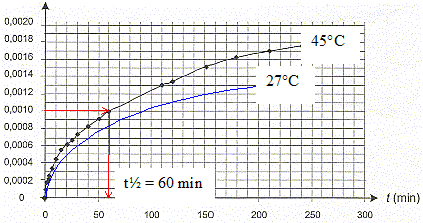
[dx/dt]t correspond au coefficient directeur de la tangente à la courbe à la date t ; la vitesse de la réaction est proportionnelle à [dx/dt]t Or les tangentes sont de plus en plus inclinées par rapport à l'horizontale : en conséquence [dx/dt]t et donc la vitesse diminuent au cours du temps. Le taux d'avancement final de cette transformation : En poursuivant l'expérience pendant une durée suffisante, on obtient une concentration finale : [NH4+]f = 2,0 10 -2 mol.L-1 xf = [NH4+]f * V = 0,02*0,1 = 2,0 10-3 mol. t = xf/ xmax =2,0 10-3/ 0,02 = 0,10 , valeur très inférieure à 1, la transformation est donc limitée. Le temps de demi-réaction : Durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final soit x½ = 0,001 mol.
Les ions ammonium finissent par se transformer en ions nitrate dont l'accumulation risque de compromettre la vie des poissons. Ces derniers ions constituent un aliment essentiel pour les plantes vertes de l'aquarium. Expliquer pourquoi dans les livres d'aquariophilie, on dit que l'aquarium doit être "bien planté". La présence de nombreuses plantes dans l'aquarium consomme les ions nitrates : en conséquence, ces derniers ne peuvent pas s'accumuler et la vie des poissons n'est pas compromise.
|
||||||||||||||||||||||
| |
|||||||||||||||||||||||
|
|