|
Corrosion des gouttières
Les précipitations sont naturellement acides en raison du
dioxyde de carbone présent dans l'atmosphère. Par ailleurs, la
combustion des matières fossiles (charbon, pétrole et gaz) produit du
dioxyde de soufre et des oxydes d'azote qui s'associent à l'humidité de
l'air pour libérer de l'acide sulfurique et de l'acide nitrique. Ces
acides sont ensuite transportés loin de leur source avant d'être
précipités par les pluies, le brouillard, la neige ou sous forme de
dépôts secs.
Très souvent, les pluies s'écoulant des toits sont recueillies
par des gouttières métalliques constituées de zinc.
Données : Masse molaire atomique du zinc : M(Zn) = 65,4
g.mol ; loi des gaz parfaits : PV = nRT
Couples acide/base : H3O+/H2O
(l) ; H2O (l)/HO- (aq) ; CO2, H2O
(l)/HCO3-(aq)
Le zinc est un métal qui réagit en milieu acide selon la
réaction d'équation : Zn (s) + 2 H3O+ = Zn2+
(aq) + H2 (g) + 2 H2O (l)
- Suivi cinétique de la transformation :
Pour étudier cette transformation, considérée comme
totale, on réalise l'expérience dont le schéma simplifié est représenté
sur la figure 1.
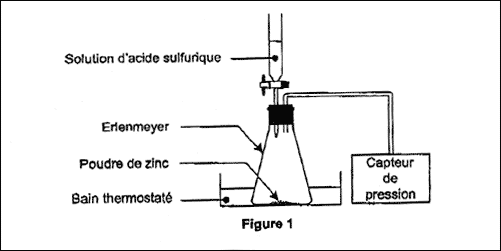
A l'instant de date t = 0 s, on verse rapidement, sur 0,50
g de poudre de zinc, 75,0 mL de solution d'acide sulfurique de
concentration en ions oxonium H3O+ égale à 0,40
mol.L-1. La pression mesurée à cet instant par le capteur
est Pi = 1020 hPa. La formation de dihydrogène crée une
surpression qui s'additionne à la pression de l'air initialement
présent. Les valeurs de la pression, mesurée à différentes dates par le
capteur de pression, sont reportées dans le tableau suivant :
|
t(min)
|
0
|
1,0
|
3,0
|
5,0
|
7,0
|
9,0
|
11,0
|
15,0
|
20,0
|
25,0
|
30,0
|
35,0
|
|
P(hPa)
|
1020
|
1030
|
1060
|
1082
|
1101
|
1120
|
1138
|
1172
|
1215
|
1259
|
1296
|
1335
|
|
t(min)
|
45,0
|
50,0
|
60,0
|
70,0
|
80,0
|
90,0
|
110,0
|
140,0
|
160,0
|
190,0
|
240,0
|
300,0
|
|
P(hPa)
|
1413
|
1452
|
1513
|
1565
|
1608
|
1641
|
1697
|
1744
|
1749
|
1757
|
1757
|
1757
|
- Etablir le tableau d'évolution du système.
- En déduire la valeur de l'avancement maximal xmax. Quel
est le réactif limitant ?
- On considère que le dihydrogène libéré par la réaction est un gaz
parfait. A chaque instant la surpression (P — Pi) est
proportionnelle à la quantité n(H2) de dihydrogène formé et
inversement proportionnelle au volume Vgaz de gaz contenu
dans l'erlenmeyer : (P — Pi) Vgaz = n(H2)
RT, où Pi représente la pression mesurée à la date t = 0 s,
P la pression mesurée par le capteur et T la température du milieu
(maintenue constante pendant l'expérience).Quelle est la relation
donnant l'avancement x de la réaction en fonction de (P — Pi),
Vgaz, R et T ?
On note Pmax la pression mesurée à l'état final. Ecrire la
relation donnant l'avancement xmax en fonction de Pmax, Pi,
Vgaz, R et T. En déduire la relation donnant l'avancement x
=xmax(P — Pi)/(Pmax — Pi).
La courbe donnant l'évolution de l'avancement x en fonction du temps
est représentée sur la figure 2 ci-dessous. Vérifier à l'aide de la
courbe la valeur de xmax trouvée précédemment.
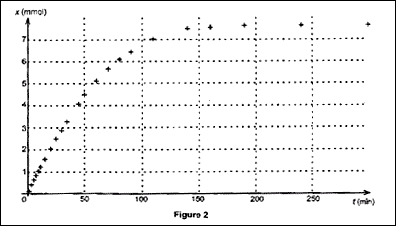
A l'aide du tableau des résultats, déterminer la valeur de
l'avancement à la date t = 50,0 min. Vérifier cette valeur sur la
courbe.
Comment peut-on déduire de la figure 2 l'évolution de la vitesse
volumique de réaction au cours de la transformation chimique étudiée ?
Décrire qualitativement cette évolution.
- Facteurs cinétiques :
2.1. Influence de la concentration en ions oxonium
On reprend le montage précédent (figure 1) et on réalise
les trois expériences suivantes :
|
expérience 1
|
expérience 2
|
expérience 3
|
|
température (°C)
|
25
|
25
|
25
|
|
masse initiale de zinc en poudre
|
0,50 g
|
0,50 g
|
0,50 g
|
|
volume acide sulfurique versé (mL)
|
75
|
75
|
75
|
|
concentration initiale en ion oxonium (mol/L)
|
0,50
|
0,25
|
0,40
|
Pour chacune des expériences 1, 2 et 3, on a tracé sur la figure 3
ci-dessous les trois courbes (a), (b) et (c) représentant l'avancement
de la réaction lors des 50 premières minutes.
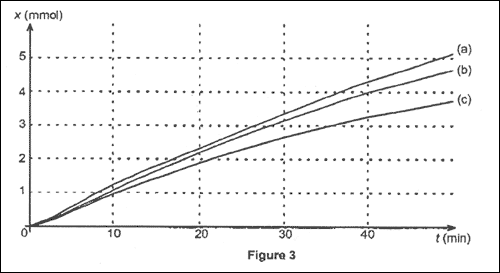
Associer à chacune des courbes de la figure 3 le numéro de
l'expérience 1, 2 ou 3 correspondante. Justifier.
- Influence de la forme du zinc (division et état de surface) :
On reprend le montage de la figure 1 et on réalise trois nouvelles
expériences : avec de la poudre de zinc ; avec de la grenaille de zinc
récemment fabriquée ; avec de la grenaille de zinc de fabrication
ancienne.
|
expérience4
|
expérience5
|
expérience 6
|
|
température (°C)
|
25
|
25
|
25
|
|
masse initiale de zinc (g)
|
0,50
|
0,50
|
0,50
|
|
forme du zinc
|
poudre
|
grenaille
|
grenaille de sinc fabrication ancienne
recouverte d'une couche de carbonate de zinc
|
|
Volume de la solution d'acide sulfurique versé
(mL
|
75
|
75
|
75
|
|
Concentration initiale en ions oxonium (mol/L)
|
0,50
|
0,50
|
0,50
|
On trace les courbes × = f(t) pour les trois expériences et on obtient
la figure 4 ci-dessous :
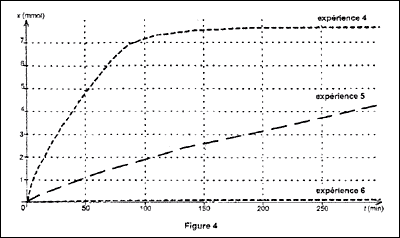
A partir des courbes obtenues lors des expériences 4 et 5,
indiquer quelle est l'influence de la surface du zinc en contact avec
la solution sur la vitesse de réaction.
En milieu humide, le zinc se couvre d'une mince couche de carbonate de
zinc qui lui donne un aspect patine. A partir des courbes obtenues,
indiquer quelle est l'influence de cette couche de carbonate de zinc
sur la vitesse de réaction.
- Pluies acides et gouttières :
Les précipitations naturelles et non polluées ont un pH
acide. Leur acidité est due au dioxyde de carbone qui se dissout dans
l'eau.
L'équation entre l'eau et le dioxyde de carbone s'écrit :
CO2 (aq) + 2H2O (l) = HCO3-(aq)
+ H3O+.
En France le pH moyen annuel des eaux de pluie est de
l'ordre de 5. A partir de la valeur du pH citée, déterminer la valeur
moyenne de la concentration en ions oxonium H3O+
rencontrés dans les eaux de pluie.
Les trois facteurs cinétiques étudiés dans la question 2.
permettent-ils d'expliquer la longévité des gouttières en zinc dans les
habitations ?
corrigé
Suivi cinétique de la
transformation :
Quantités de matière initiales :
Zinc : n(Zn) = m(g) / M(Zn) = 0,50 / 65,4 = 7,6 10-3
mol
ion oxonium : n(H3O+)= volume solution
(L) * concentration (mol/L) = 0,075*0,4 = 3,0 10-2 mol
|
avancement (mol)
|
Zn (s)
|
+ 2 H3O+
|
= Zn2+ (aq)
|
+ H2 (g)
|
+ 2 H2O (l)
|
|
initial
|
0
|
7,6 10-3
|
3,0 10-2
|
0
|
0
|
solvant en grand excès
|
|
en cours
|
x
|
7,6 10-3-x
|
3,0 10-2-2x
|
x
|
x
|
|
fin
|
xmax
|
7,6 10-3-xmax
|
3,0 10-2-2xmax
|
xmax
|
xmax
|
si le zinc est en excès : 7,6 10-3-xmax = 0 soit xmax
=7,6 10-3 mol
si l'acide est en excès : 3,0 10-2-2xmax
= 0 soit xmax =1,5 10-2 mol
on retient la plus petite valeur : xmax =7,6 10-3
mol ( zinc en défaut)
La courbe x(mmol) = f(t) tend vesre une valeur limite (
asymptote horizontale ) égale à 7,6 mmol
relation donnant l'avancement x de la réaction en fonction de
(P — Pi), Vgaz, R et T :
loi des gaz parfaitx : (P — Pi) Vgaz =
n(H2) RT
le tableau d'avancement indique : x= n(H2) d'où :
(P — Pi) Vgaz = x RT (1)
relation donnant l'avancement xmax en fonction de Pmax,
Pi, Vgaz, R et T : (Pmax — Pi)
Vgaz = xmax RT (2)
diviser (1) par (2) : (P — Pi) / (Pmax — Pi)
= x/ xmax
soit x =xmax(P — Pi)/(Pmax — Pi).
valeur de l'avancement à la date t = 50,0 min : P= 1452
hPa ; Pi= 1020 hPa ; Pmax = 1757 hPa.
x= xmax(P — Pi)/(Pmax — Pi)=
7,6(1452-1020) / ( 1757-1020) = 4,5 mmol.
cette valeur se retrouve sur la courbe.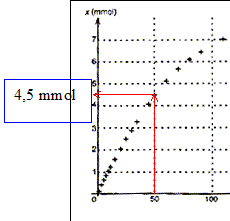
évolution de la vitesse volumique de réaction au cours
de la transformation chimique étudiée :
tracer les tangentes à diférentes dates à la courbe x= f(t) ;
les coefficients directeurs de ces tangentes donnent dx/dt ; diviser
par le volume V de la solution pour obtenir la vitesse v = 1/V dx/dt.
Les tangentes sont de plus en plus inclinées sur l'horizontale
au cours du temps ; les coeffidinet directeurs de ces droites diminuent
au cours du temps : la vitesse de la réaction diminue au cours du temps
( du fait de la diminution des quantités de matière des réactifs).
Zn (s) + 2 H3O+ = Zn2+ (aq) +
H2 (g) + 2 H2O (l)
Facteurs cinétiques :
à chacune des courbes de la figure 3 le numéro de
l'expérience 1, 2 ou 3 correspondante :
Pour les trois expériences, la température et la masse de zinc
sont identiques ; par contre les quantités de matière d'ion oxonium (
volume * concentration) sont différentes.
Or la concentration de l'ion oxonium, l'un des réactifs, est
un facteur cinétique : la vitesse, à une date donnée, est d'autant plus
grande que la concentration de cet ion est grande.
d'où l'assoaciation : ( courbe a : expérience 1) ; ( courbe b
: expérience 3) ;( courbe c : expérience 2) ;
Influence de la forme du zinc (division et état de
surface) :
influence de la surface du zinc en contact avec la solution
sur la vitesse de réaction :
poudre : grande surface de contact ( expérience 4) ; grenaille
: surface de contact plus faible que pour la poudre ( expérience 5)
à une date donnée, la vitesse est d'autant plus grande que la
surface du réactif solide est grande.
En milieu humide, le zinc se couvre d'une mince couche de carbonate de
zinc qui lui donne un aspect patine. ( expérience 6) : la vitesse de la
réaction est quasiment nulle ; le métal zinc est protégé d'une attaque
de l'acide par la couche "protectrice" de carbonate de zinc.
Pluies acides et gouttières
:
En France le pH moyen annuel des eaux de pluie est de l'ordre
de 5. La valeur moyenne de la concentration en ions oxonium H3O+
rencontrés dans les eaux de pluie est [H3O+]= 10-pH
= 10-5 mol/L.
Les trois facteurs cinétiques étudiés permettents d'expliquer la
longévité des gouttières en zinc dans les habitations :
en effet la concentration en ion oxonium est faible, le métal
est protégé par une couche de carbonate de zinc protectrice, le métal
présente une très faible surface de contact ( par rapport à une poudre)
avec les acides.
|




