|
d'après bac S |
||||
|
||||
|
|
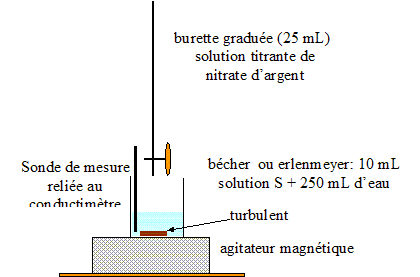
On prélève un volume V0 = 20,0 mL de lait (solution S0) et on les introduit dans une fiole jaugée de volume VS = 100,0 mL : le facteur de dilution F est égal à : F= VS /V0 = 100/20 = 5. De plus F= C0 /CS d'où : C0 =5CS. prélever V1 = 10,0 mL de la solution S : verser un peu de solution S dans un bécher, prendre une pipette jaugée de 10,0 mL ( rincée avec la solution S) surmontée d'un pipeteur ; utiliser un autre bécher pour placer ce prélevement. schéma annoté du dispositif expérimental de suivi conductimétrique :
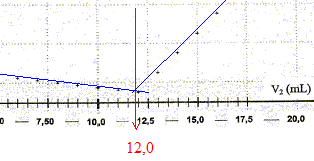
La conductivité initiale de la solution est due à tous les ions qu'elle contient et en particulier à l'ion chlorure. variation de la valeur de la conductivité s du milieu réactionnel au cours du dosage : avant l'équivalence, les ions chlorure sont en excès, les ions argent ajoutés sont tous consommés ; on ajoute des ions nitrate d'où l'expression de la conductivité s du milieu réactionnel : s = lCl- [Cl-] + lNO3- [NO3-]. Du point de vue de la conductivité, tout se passe comme si on remplaçait les ions chlorure par les ions nitrate ; de plus le volume de la solution est à peu près constant : or lNO3- <lCl- , en conséquence la conductivité va diminuer. après l'équivalence, les ions chlorure ont disparu, les ions argent ajoutés ne sont plus consommés ; on ajoute des ions nitrate d'où l'expression de la conductivité s du milieu réactionnel : s = lAg+ [Ag+] + lNO3- [NO3-]. Les concentrations de ces deux ions croissent et en conséquence la conductivité va augmenter. L'abscisse du point particulier, intersection des deux segments de droites, apparaissant sur la courbe s = f(V2) , donne le volume de solution titrante ajouté à l'équivalence. V2E =12,0 mL
D'après les coefficients stoechiométriques de l'équation de réaction : Ag+(aq) +Cl-(aq) = AgCl(s), à l'équivalence la quantité de matière en ions argent introduits est égale à la quantité de matière en ions chlorure initialement présents. C2V2E =V1CS d'où CS =C2V2E /V1 = 5,00 10-3 * 12,0 / 10,0 = 6,00 10-3 mol/L en tenant compte de la dilution, C0 = 5 CS =3,00 10-2 mol/L. Masse d'ions chlorure présents dans 1 L de lait étudié
: CS *M(Cl-) = 3,00 10-2 *35,5 =1,07 g/L.
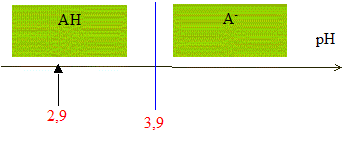
le pH initial du lait est pH= 2,9 ; l'équivalence est obtenue pour VBE= 12 mL de soude. Equation de la réaction qui se produit lors du mélange : HA + HO- = A- + H2O Une réaction adaptée à un dosage doit être totale et rapide. Expression de la constante de réaction K correspondante : K= [A- ]/([HA][HO- ]) ( 1) de plus AH + H2O = A- + H3O+ avec Ka3 = [A- ][H3O+]/[AH] soit [A- ] / [AH] = Ka3 /[H3O+] repport dans (1) : K=Ka3 /([H3O+][HO- ]) = Ka3 / Ka1 = 10-3,9 / 10-14 = 1010,1. Je conclus : K étant très grand, [HA]éq , figurant au dénominateur dans l'expression de K, est très faible : la réaction est donc bien totale. Utiliser un diagramme de prédominance :
pH début < pKa3 donc l'espèce chimique prédominante au début du dosage est AH. HA(aq) et A-(aq) sont présents en quantités égales lorsque pH = pKa3 c'est à dire à la demi-équivalence de ce dosage ( V=½VB= 6 mL) quantité de matière d'acide lactique présente dans le volume VA de lait : à l'équivalence, les quantités de matière de réactifs mis en présence sont en proportions stoechiomètriques : VACA= VBCB soit CA= VBCB / VA = 12,0*5,00 10-2 / 20,0 = 3,00 10-2 mol/L. soit 3,00 10-2 / 50 = 6,00 10-4 mol AH dans 20 mL de lait. Masse d'acide lactique présente dans un litre de lait : M(HA) CA= 90* 0,0300 = 2,7 g/L. M(acide lactique)= M(HA) = 90 g.mol-1 On considère qu'un lait frais a une concentration en acide lactique inférieure à 1,8 g.L-1 ; la valeur trouvée, 2,7 g/L étant supérieure à 1,8 g/L, ce lait n'est donc pas frais..
|
|||
| |
||||
|
|