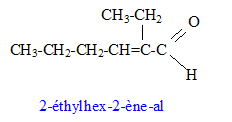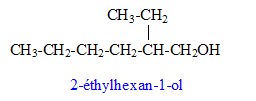|
électrode d'argent, dosage Ca2+, phtalate de di(2-éthylhexyle), N-méthyl-propanamide |
||||
|
||||
|
|
Pour l’électrode de référence au sulfate mercureux, Eréf = + 0,650 V ; masse molaire de l’argent : 108 g.mol-1 ; pour le couple Ag+/Ag : E° = + 0,800 V ; on prendra RT/F ln(x) =0,06 log(x), en V.
corrigé potentiel EAg pris par le fil d’argent plongeant dans la solution Ag++ e-=Ag(s) ; EAg= E° + 0,06 log [Ag+] =0,8 +0,06 log [Ag+] expression : D E =EAg-Eréf =E° -Eréf + 0,06 log [Ag+] concentration de cette solution en ions Ag+ : 0,066 = 0,8-0,65 + 0,06 log [Ag+] ; 0,06 log [Ag+] = -0,084 log [Ag+] = -0,084/0,06 = -1,4 ; [Ag+] = 3,98 10-2 mol/L solubilité du sulfate d’argent : s = [Ag+] produit de solubilité Ks du sulfate d’argent : Ag2SO4 (s) = 2Ag++ SO42- ; Ks = [Ag+]2[SO42-] la solution est électriquement neutre : 2[SO42-] =[Ag+] d'où Ks =[Ag+]2 ½[Ag+] = ½[Ag+]3 =0,5*(3,98 10-2)3 =3,15 10-5. potentiel E1 de la première électrode : E1= E° + 0,06 log [Ag+] =0,8 +0,06 log 10-3 = 0,62 V concentration des ions Ag+ dans la solution obtenue à partir de l’alliage : Or DE = E1 - E2 = +0,036 V soit E2 =E1 -DE =0,62-0,036 = 0,584 V de plus E2 = E° + 0,06 log [Ag+]2 = 0,8 +0,06 log [Ag+]2 soit 0,06 log [Ag+]2 =E2- E°= 0,584-0,8 = -0,216 V log [Ag+]2 = -0,216/0,06 =-3,6 soit [Ag+]2 = 2,51 10-4 mol/L. pourcentage d’argent dans l’alliage : Quantité de matière d'ion argent dans 0,1 L : concentration (mol/L) * volume de la solution (L) = 2,51 10-4 *0,1 = 2,51 10-5 mol masse d'argent (g) = masse molaire (g/mol) * quantité de matière (mol) = 108* 2,51 10-5 =2,71 10-3 g = 2,71 mg. % Ag : 2,71/40*100 = 6,78 %.
|
|||
|
Données, à 25 °C : produit ionique de l’eau : Ke = 1,0 × 10-14 ; produit de solubilité du carbonate de calcium : Ks = 5,0 × 10-9 ; constante d'acidité du couple CO32-/HCO3- : Ka = 6,3 × 10-11. On étudie un produit renfermant un constituant L, ligand capable de complexer les ions Ca2+. Le dosage de L se fait de la manière suivante : À 10,0 mL de solution de carbonate de sodium à environ 0,1 mol.L-1, on ajoute 20,0 mL de solution d’échantillon contenant L (tous les constituants sont inertes vis à vis de CO32-) et 10 mL d'une solution tampon permettant de fixer le pH à la valeur pH = 11. On obtient une solution (S). La solution obtenue est dosée par une solution de chlorure de calcium à 0,100 mol.L-1 ; l'équivalence est repérée par la précipitation du carbonate de calcium.
corrigé Définir l'équivalence du dosage : à l'équivalence les quantités de matière des réactifs mis en présence sont en proportions stoéchiomètriques ; avant l'équivalence, l'un des réactifs est en excès ; après l'équivalence, l'autre réactif est en excès. concentration de L dans la solution d'échantillon : n( Ca2+)éq= [Ca2+]* Véq ; n(L) = [L]*V ; [Ca2+]* Véq= [L]*V ; [L] = [Ca2+]* Véq/ V = 0,1*10/20=0,05 mol/L expression littérale de la constante Kf : Kf = [CaL2+] / ([Ca2+][L]) concentration en [Ca2+] à l'équivalence : Dans la solution ( 50 mL), à l'équivalence, la conservation de L impose : [L]0 = [CaL2+]éq Qté de matière L dans 20 mL : 0,05*0,02 = 10-3 mol ; soit [CaL2+]éq = 10-3 / 0,05 = 0,02 mol/L. d'après Ca2+ + L =CaL2+ : [Ca2+] éq = [L]éq ; Kf = [CaL2+]éq / [Ca2+]2éq ; [Ca2+]éq = ( [CaL2+]éq /Kf )½ =(0,02 /1,6 × 108 )½ =1,12 10-5 mol/L expression littérale de la constante d'acidité du couple CO32-/HCO3- : HCO3- + H2O =CO32-+ H3O+ (1) Ka = [CO32-][H3O+] / [HCO3-] concentration en ions carbonate dans la solution (S) : pH= 11 ; [H3O+] = 10-11 mol/L [CO32-] / [HCO3-] = Ka / [H3O+] = 6,3 10-11 / 10-11 = 6,3 soit [HCO3-] = [CO32-] /6,3. conservation de l'élément carbone dans S : [CO32-]+ [HCO3-] = 0,1*10/40 = 0,025 mol/L ( prendre en compte la dilution de facteur F= 4) [CO32-] +[CO32-] /6,3 = 0,025 ; [CO32-] = 2,16 10-2 mol/L. concentration en Ca2+ lorsque le précipité de carbonate de calcium apparaît : CaCO3 (s) = Ca2+ + CO32- ; Ks = [CO32-][Ca2+] soit [Ca2+] = Ks / [CO32-] = 5,0 × 10-9 / 1,7 10-2 = 2,94 10-7 mol/L. Le précipité apparaît dès que [Ca2+] = 2,94 10-7 mol/L ; or [Ca2+]éq vaudrait 1,12 10-5 mol/L en absence de précipité. Le précipité apparaît donc avant l'équivalence
|
||||
|
Un plastifiant du polychlorure de vinyle (PVC) est un diester aromatique qui peut être synthétisé par réaction entre un alcool J et l’acide benzène-1,2-dicarboxylique.
corrigé 
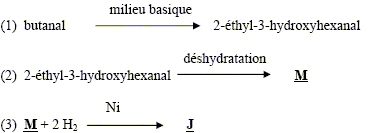
aldolisation : condensattion en milieu basique formule semi-développée de M : Les réactions de déshydratation suivent la règle de Zaïtsev : l’alcène le plus substitué se forme préférentiellement. formule semi-développée de J : addition de H2 sur la double liaison carbone- carbone et réduction de l'aldehyde en alcool primaire On note CH3-F-CH3 le 1,2-diméthylbenzène CH3-F-CH3 + 4 H2O = HOOC-F-COOH + 12e- + 12H+ oxydation 2 Cr2O72- + 28 H+ +12e- = 4 Cr3+ + 14 H2O réduction CH3-F-CH3 +2 Cr2O72- + 16H+ = HOOC-F-COOH + 4 Cr3+ + 10 H2O équation de la réaction entre J et l’acide benzène-1,2-dicarboxylique :
Le phtalate de di(2-éthylhexyle) (DEHP) est le plastifiant le plus utilisé de l'industrie du polychlorure de vinyle (PVC), Pour améliorer le rendement de cette réaction : utiliser l'un
des réactifs en excès, éliminer l'un des produits au fur et à mesure
qu'il se forme
|
||||
|
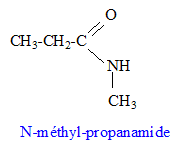
Un amide primaire N-substitué A a une masse molaire M = 87 g.mol-1. Sa composition massique centésimale est :C : 55,2 % ; H : 10,3 % ; O : 18,4 % ; N : 16,1 %. Masse atomique ( g/mol) : C : 12 ; H : 1,0 ; O : 16 ; N : 14 ; K : 39.
corrigé la formule brute de A : CxHyOz Nt. 12x/55,2 = 0,87 soit x= 4 ; y/10,3 = 0,87 soit y = 9 ; 16 z /18,4 = 0,87 soit z = 1 ; 14t/16,1 = 0,87 soit t =1 ; C4H9ON. équation de la réaction de A avec la solution d’hydroxyde de potassium : amide primaire monosubstitué à l'azote : R-CO-NHR' R-CO-NHR' + (K+ ; HO-)-->R-COO- + K+ + R'-NH2. Masse molaire de B : (R-COO- + K+ ) ou CnH2n-1 O2K : M= 14 n+70 Or B contient 34,9 % de potassium en masse : 39/0,349 = 14 n +70 soit n = 3 CH3-CH2-COO- + K+ : propanoate de potassium acide carboxylique B’ correspondant : acide propanoïque CH3-CH2-COOH formule semi-développée de l’amine C : CH3-NH2 méthanamine formule semi-développée de A : le spectre infrarouge de D présente une large bande
d’absorption vers 3400 cm-1 : la fonction chimique présente
dans D est une fonction alcool ( association par liaisons hydrogène
intermoléculaires) amine primaire traitée par NaNO2 +HCl à 5°C CH3 -NH2 + NaNO2 + HCl -->CH3-OH + N2 +H2O +NaCl
|
||||
|
|