|
|
||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||
|
|
La menthe poivrée, calmante (maux de tête, coups de soleil) mais aussi stimulante, digestive, antispasmodique et antiseptique est bien connue pour ses bienfaits depuis des siècles. Utilisée en parfumerie, son huile essentielle contient un ester très odorant : l'éthanoate de menthyle que l'on peut synthétiser en laboratoire, à partir de menthol et d'un acide carboxylique. I- Préliminaires : Le menthol a pour formule semi-développée :
II- Synthèse de l'éthanoate de menthyle : Protocole expérimental de l'expérience n°1: Afin de synthétiser l'éthanoate de menthyle, on introduit dans un erlenmeyer maintenu dans la glace : 0,10 mol d'acide carboxylique précédent, 0,10 mol de menthol,quelques gouttes d'acide sulfurique concentré. On répartit de façon égale le mélange dans 10 tubes à essais que l'on surmonte d'un réfrigérant à air. On plonge simultanément les 10 tubes dans un bain marie thermostaté à 70°C et on déclenche le chronomètre. À intervalles de temps réguliers, on place un tube à essai dans un bain d'eau glacée et on dose l'acide restant par une solution d 'hydroxyde de sodium (Na +(aq) + HO -(aq)) en présence d'un indicateur coloré approprié. Les résultats obtenus permettent de tracer la courbe d'évolution de la quantité de matière d'ester formée en fonction du temps ( nester formé = f ( t )) : 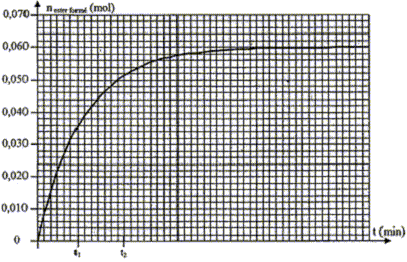
III- Exploitation des résultats :
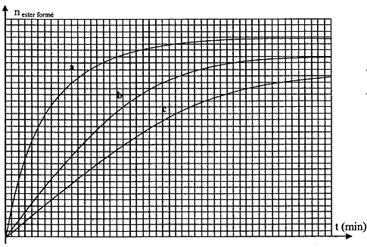
IV- Influence des conditions expérimentales : On réalise 3 autres expériences de façon analogue à l'expérience n°1 mais en faisant varier les conditions expérimentales (température, quantité de matière initiale des réactifs) suivant le tableau ci-dessous :
Le menthol appartient à la famille chimique des alcools ( alcool secondaire). Nom et formule semi-développée de l'acide carboxylique qui, par réaction avec le menthol, permet de synthétiser l'éthanoate de menthyle : acide éthanoïque ou acétique : CH3-COOH. Equation de la réaction de synthèse de l'ester : CH3-COOH + ROH = CH3-COOR + H2O expression du quotient de réaction Qr = [CH3-COOR][H2O] / ([ROH][CH3-COOH]) ; Qr i =0 car [CH3-COOR]i= [H2O]i =0 ; La constante d'équilibre K associée à cette réaction est égale à 2,3 à 70°C ; d'autre part Qr i =0 ; Qr i < K le critère d'évolution spontanée indique une évolution du système dans le sens direct, de la gauche vers la droite. On place les tubes à essais dans la glace avant titrage afin de réaliser un blocage cinétique : la composition du milieu réactionnel n'évolue plus. Equation de la réaction associée au titrage de l'acide carboxylique par la solution d'hydroxyde de sodium : CH3-COOH + HO- = CH3-COO- + H2O Tableau d'avancement associé à la réaction et calcul de xmax :
Calcul du rendement de la réaction : on détermine xfin à l'aide du graphe nester= f(t) ; l'asymptote horizontale coupe l'axe des ordonnées à xfin= 0,06 mol rendement h= xfin/xmax = 0,06/0,1 = 0,6 ( 60 %) Je conclus que la réaction d'estérification est limitée ( par l'hydrolyse de l'ester) Quotient de réaction à l'équilibre en fonction de l'avancement final xf et des quantités de matière initiales : Qr éq= [CH3-COOR]éq[H2O]éq / ([ROH]éq[CH3-COOH]éq) = x2éq /(0,1-xéq)2 avec xéq = 0,06 mol Valeur de la constante d'équilibre K = Qr éq= (0,06/ (0,1-0,06))2 = 2,25, soit K= 2,3) valeur cohérente avec la valeur donnée ( écart relatif inférieur à 0,05*100 / 2,3 =2,2 %) Evaluation graphique de la vitesse de la réaction : à la date t considérée, tracer la tangente à la courbe nester= f(t) le coefficient directeur de cette tangente donne [dx/dt]t. or la vitesse de la réaction est égale à vt = 1/V [dx/dt]t diviser le coefficient directeur de la tangente par le volume V (L) du milieu réactionnel pour trouver la valeur de la vitesse. Evolution de la valeur de la vitesse de la réaction au cours du temps : à t = t1 le coefficient directeur de la tangente à la courbe nester= f(t) est supérieur au coefficient directeur de la tangente à la courbe nester= f(t) à t = t2. donc v1>v2 ; je conlus que la vitesse de la réaction diminue au cours du temps : en effet les concentrations des réactifs, facteur cinétique, diminuent au cours du temps. Influence des conditions expérimentales : Dans l'expérience n°3, deux facteurs cinétiques interviennent : la concentration d'un réactif est doublée et la température du milieu est 70°C. La vitesse initiale de la réaction sera la plus grande et l'équilibre sera plus rapidement atteint : donc courbe a. Dans l'expérience n°1, un facteur cinétique intervient : la température du milieu est 70°C. La vitesse initiale de la réaction sera plus faible ( par rapport à l'expérience n°3) et l'équilibre sera un peu moins rapidement atteint : donc courbe b. Dans l'expérience n°2, concentrations des réactifs et température sont les plus faibles ; en conséquence la vitesse initiale sera la plus petite et l'équilibre sera atteint au bout d'un temps assez long ( courbe c).
|
|||||||||||||||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||
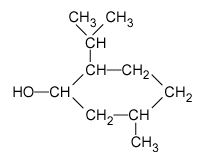 Dans
la suite de l'exercice, on le notera pour simplifier R-OH
Dans
la suite de l'exercice, on le notera pour simplifier R-OH