|
|
||||||||||||||||||
|
||||||||||||||||||
|
|
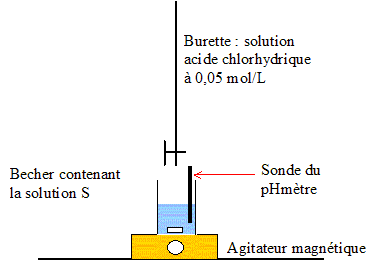
Une solution commerciale utilisée pour déboucher les éviers, canalisations, etc. est essentiellement constituée d’une base B. Le flacon porte les indications suivantes : Danger – Produit corrosif. Cet exercice a pour objectifs de déterminer : – s’il s’agit d’une base forte ou d’une base faible ; – la concentration de la solution commerciale . Pour faire cette étude expérimentale, les seuls matériels et produits disponibles sont donnés dans la liste suivante : Matériel : – pH-mètre électrode système d’agitation ; – fioles jaugées : 50 mL, 100 mL, 200 mL ;– propipette (poire aspirante) ;– pipettes jaugées : 1 mL, 5 mL, 10 mL, 20 mL ;– burette de 25 mL graduée au 1/10 mL ;– bechers. Produits utilisés : – eau distillée ;– solution commerciale de « produit déboucheur » S0 de concentrationC0 ; – solution d’acide chlorhydrique de concentration :CA= 0,050 mol/L ; – solution d’indicateurs colorés. A. Étude d’une propriété de la base B :
B. Détermination de la concentration :
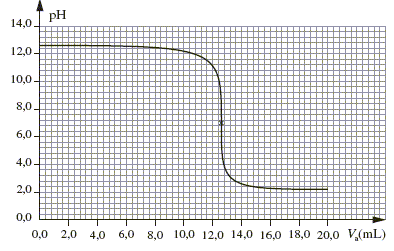
C. Choix d’indicateur(s) coloré(s) : À partir de la courbe obtenue lors de l’étude de l’évolution du pH en fonction du volume d’acide versé, il est possible de choisir correctement un (ou plusieurs) indicateur(s) coloré(s) pour déterminer la concentration de la solution S lors du dosage.
le volume de la fiole jaugée ( 200 mL) doit être 200 fois plus grand que celui de la pipette jaugée (1 mL) : prélever 1 mL S0 à la pipette jaugée ; placer dans la fiole jaugée de 200 mL ; compléter avec de l'eau distilée jusqu'au trait de jauge ; agiter pour rendre homogène. volume de la solution S : 200 mL.
équation de la réaction qui se réalise dans le becher : B- +H3O+ = H2O + BH quantité d’ion oxonium H3O+ apportée lorsqu’on a introduit un volume VA= 8 mL d’acide chlorhydrique telle que CA= 0,05 mol/L : concentration (mol/L) * volume de la solution (L) = 0,05* 8 10-3 = 4 10-4 mol.
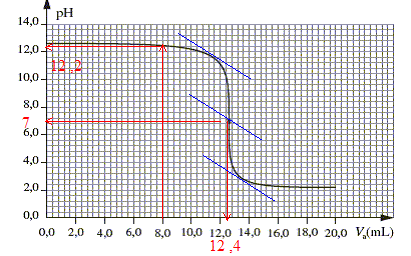
pH= 12,2 soit [H3O+ ]=10-12,2 =6,3 10-13 mol/L soit dans un volume de 28 mL : 6,3 10-13 *0,028 = 1,8 10-14 mol d'ion oxonium restant. 1,8 10-14 << 4 10-4 tous les ions
oxonium ont réagi avec la base BH : la réaction est donc totale.
à l'équivalence acide base les quantités de matière des réactifs mis en présencesont en proportions stoéchiomètriques : CAVéqui= CBVB soit CB= CAVéqui/VB =0,05*12,4 / 20 = 3,1 10-2 mol/L d'où en tenant
compte de la dilution : C0 = 200*0,031 = 6,2 mol/L.
Dans une solution incolore à pH=5 (valeur supérieure au pKa de l'indicateur coloré ), l'hélianthine prend une couleur jaune, couleur de la forme basique prédominante de l'indicateur coloré. La zone de virage de l'indicateur le plus approprié doit contenir le pH du point équivalent, pH =7 dans ce cas : d'où le choix du bleu de bromothymol.
|
|||||||||||||||||
|
|