|
|
||||
|
||||
|
|
formule brute : C2H4O2 ; autre nom : acide éthanoïque ; formule semi développée : 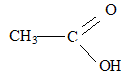
On veut fabriquer 2,0 L d'une solution aqueuse à 1,0 mol/L de cet acide : masse de 1 L de solution commerciale : 1,05 kg = 1050 g n= m/M = 1050/60,05 = 17,5 mol dans 1 L facteur de dilution F= 17,5 / 1 = 17,5 volume de solution mère à prélever pour préparer 2 L de solution à 1 mol/L : 2 /17,5 = 114,4 mL liste du matériel : fiole jaugée 2 L ; burette graduée ou pipette graduée + pipeteur consignes de sécurité : port de blouse, gants lunettes et travail sous hotte. prélever 114,4 mL de la solution commerciale ( burette graduée ou pipette graduée) ; verser dans la fiole jaugée de 2 L, contenant un peu d'eau distillée. compléter avec eau distillée jusqu'au trait de jauge ; agiter pour rendre homogène
préparer 500,0 mL d'une solution d'acide acétique de concentration 0,0100 mol/L à partir de la solution précédente : F= 1/0,01 = 100 ; volume pipette jaugée = 500/100 = 5 mL prélever 5 mL de la solution mère ( pipette jaugée + pipeteur) ; verser dans la fiole jaugée de 500 mL. compléter avec eau distillée jusqu'au trait de jauge ; agiter pour rendre homogène.
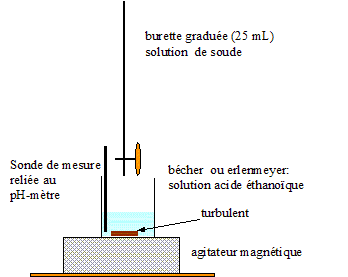
On introduit dans un bécher 20,0 mL d'une solution d'acide acétique de concentration Ca= 0,0100 mol/L. On ajoute progressivement une solution d'hydroxyde de sodium de concentration Cb =0,0100 mol/L et on mesure le pH de la solution obtenue. On appelle Vb le volume de solution d'hydroxyde de sodium versé.
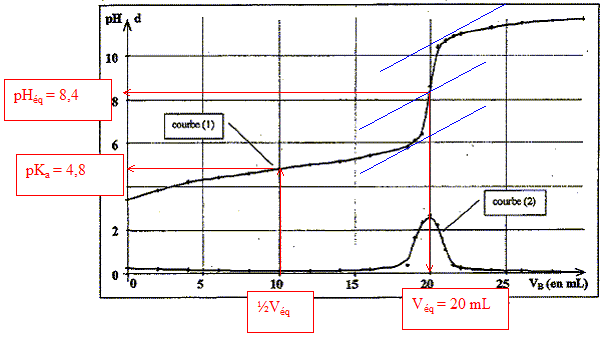
schéma du dispositif expérimental. définition de l'équivalence : à l'équivalence les quantités de matière d'acide et de base mis en présence sont en proportions stoechiomètriques. Avant l'équivalence, dans le bécher, l'acide est en excès ; après l'équivalence la base est en excès.
l'acide acétique est un acide faible : le pH à l'équivalence
est différent de 7 ; le pH à la demi-équivalence permet de déterminer
le pKa ( on trouve 4,8 alors que le pKa d'un
acide fort est égal à zéro)
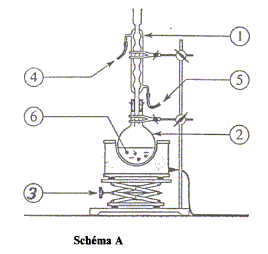
1 : réfrigérant ; 2 : ballon ( contenant les réactifs et les produits) ; 3 : élévateur à croisillons ; 4 : sortie de l'eau ; 5 : entrée de l'eau : 6 : pierre ponce nom et les caractéristiques de cette réaction : estérification, lente athermique, limitée par l'hydrolyse de l'ester. on chauffe pour accélérer la réaction chimique. nom du composé organique obtenu (ester) : éthanoate de pentyle. équation chimique de la réaction si on remplace le pentan-1-ol par le propan-1-ol : CH3-CO2H + CH3-(CH2)2-OH= CH3-CO2-(CH2)2-CH3 + H2O.
|
|||
|
|