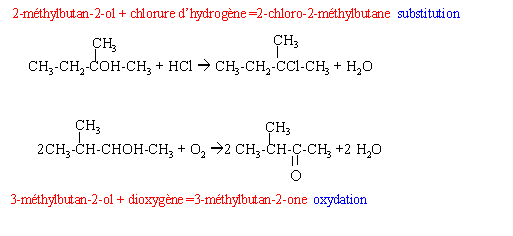
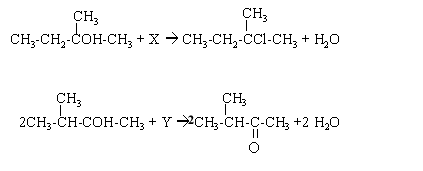|
polymère; chlorure de vinyle ; amine ; craquage du butane ; solvant chlorés ; alcools |
||||
|
|
||||
|
||||
|
Un polymère a pour masse molaire moyenne 8,75. 10 4 g/ mol et pour degré de polymérisation moyen environ n=1,4. 103. Son analyse chimique montre qu'il contient, en masse, 56,8 % de chlore 38,4 % de carbone et le reste d'hydrogène.
corrigé Masse molaire du monomère = 8,75. 10 4 / 1,4. 103 = 62,5 g/mol. formule brute CxHyClz. masse molaire 12 x +y +35,5 z= 62,5 en conséquence z ne peut être supérieur à 1. % hydrogène = 100-38,4-56,8=4,8 % 12 x / 38,4 = y / 4,8 = 35,5 z / 58,6 = 62,5 / 100= 0,625 x= 0,625*38,4/12 = 2 ; y = 0,625*4,8 = 3 ; z= 0,625*58.6/35.5=1 C2H3Cl chlorure de vinyle ( monomère) -[CH2-CHCl]- n fois polychlorure de vinyle ( polymère) En 1913, début de la production industrielle de PVC par le procédé en émulsion. En 1914, Klatte dépose le brevet de fabrication du chlorure de vinyle par réaction entre l’acétylène et le chlorure d’hydrogène. Au début des années 1930, la production industrielle du PVC apparaît. combustion du monomère : C2H3Cl + 2,5O2 --> 2 CO2 + H2O + HCl Le gaz d'odeur piquante est du chlorure d'hydrogène HCl, très soluble dans l'eau, il donne une solution d'acide chlorhydrique. (mesurer le pH de la solution ou vérifier que la solution est acide avec un papier indicateur universel) masse molaire chlorure de vinyle : 62,5 g/mol Qté de matière chlorure de vinyle (mol) = masse (g) / masse molaire (g/mol) n (chlorure de vinyle)= 1,5 1011/62,5 = 2,4 109 mol n( HCl) = 2,4 109 mol masse HCl (g)= Qté de matière (mol) * mase molaire HCl (g/mol) = 2,4 109*36,5 = 8,76 1010 g = 8,76 104 t.
|
||||
|
L'analyse d'une monoamine est réalisée par combustion de 150 mg d'amine.On obtient 355,6 mg de dioxyde de carbone et 205 mg d'eau. L'élément azote se retrouve sous forme de diazote gazeux : le volume recueilli sous 98,66 kPa, à 20 °C est 31,5 mL.
d'où n( amine) = 2 n( N2) volume molaire des gaz : V= RT/P = 8,31 * (273+20) / 9,866 104 = 2,47 10-2 m3 /mol= 24,7 L/mol n(N2 ) = volume diazote (L) / volume molaire (L/mol) = 31,5 10-3 / 24,7 = 1,275 10-3 mol n(amine) = 2*1,275 10-3 = 2,55 10-3 mol Qté de matière amine (mol) = masse (g) / masse molaire (g/mol) soit M = masse /n(amine ) M= 0,15 / 2,55 10-3 = 59 g/mol M= 12 x + y + 14 = 59 soit 12 x+y = 45 x= 3 et y = 9 CH3-CH2-CH2-NH2 : propylamine (CH3)2CH-NH2 : isopropylamine Une amine a des propriétés basiques.
|
||||
|
Le craquage catalytique du butane gazeux est effectué à 500°C sous une pression de 5,0.105 Pa. On obtient un mélange de 2 hydrocarbures gazeux appelés A et B. Une solution de permanganate de potassium en milieu basique devient verte en présence du composé B et reste violette en présence du composé A. Afin de déterminé la formule B, on fait agir sur lui une solution aqueuse de dibrome. Une masse m(B) de 0.70g de B suffit pour décolorer une solution aqueuse contenant m(Br2)=4.0 g de dibrome. Le composé A subit une déshydrogénation catalytique et se transforme en un composé C qui se comporte comme B vis-à-vis d’une solution de permanganate de potassium en milieu basique. Le composé B subit une réaction de polyaddition et forme un polymère de degré de polymérisation n=1,0.103.
corrigé Le test avec le permanganate de potassium indique que l'hydrocarbure b est insaturé : ( alcène de formule brute CnH2n) B+Br2 = B Br2 dibromoalcane Qté matière dibrome : 4/160 = 0,025 mol Qté matière B : 0,7 /M =0,025 mol d'où M= 0,7/0,025 =28 B est éthylène C2H4. craquage du butane : C4H10 --> C2H4 +C2H 6 ( éthane) déshydrogénation éthane : C2H 6 --> C2H4 + H2 polymérisation de l'éthylène : n CC2H4 -->-[-CH2--CH2]- n fois polyéthylène masse molaire du polymère : 1000 * 28 = 28 000 g/mol.
|
||||
|
Un polymère obtenu par polyaddition a pour masse molaire moyenne M = 47 040 g/mol et pour indice de polymérisation n = 1120 . Une analyse élémentaire du monomètre montre qu'il contient en masse 85,7 % de carbone et 14,3 % d'hydrogène.
formule brute du monomère CxHy ; 12 x / 85,7 = y / 14,3 = 42/100 = 0,42 x = 0,42*85,7/12 =3 ; y = 0,42*14,3 =6 CH3-CH=CH2 propène. polymérisation : nCH3-CH=CH2
--> -[-CH3CH--CH2-]-
n fois polymère
|
||||
|
Un composé chimique B ne contient que des atomes de C, H et O. Une solution aqueuse dilué de B fait rougir l'hélianthine. Le dosage de 5,0 mL de cette solution aqueuse, de concentration massique 8,4g.L-1, nécessite 7,0 mL d'une solution de soude à 0,100mol.L-1.
corrigé si l'hélianthine est rouge, c'est un acide organique. Un acide carboxylique possède le groupement -COOH Lors du dosage par la soude on a à l'équivalence : n(acide )=n(OH- )si c'est un monoacide carboxylique. n(OH- ) =COH-*Véqui = 0,1*7 10-3 = 7 10-4 mol 7 10-4 mol d'acide dans 5 mL de solution soit : 7 10-4 / 5 10-3 = 0,14 mol/L. concentration molaire (mol/L) * masse molaire (g/mol) = titre massique (g/L) d'où : M= 8,4 / 0,14 = 60 g/mol. Formule brute : CxHyO2 : 12x / 40 = y / 6,67 = M/100 = 0,6 x= 0,6*40/12 =2 ; y = 0,6*6,67 = 4 C2H4O2 soit CH3-COOH acide éthanoïque au acétique. |
||||
|
On brûle 0,500 g d'un echantillon d'une espèce chimique.
corrigé L'espèce chimique est donc seulement composée de Carbone, Hydrogène.( hydrocarbure) Le chlorure de calcium anhydre CaCl2 fixe des molécules d'eau. La prise de masse correspond à la masse d'eau contenue dans les gaz (ou fumées) de combustion, soit 643 mg d'eau. Il ne reste que CO2 qui ne réagit pas avec le chlorure de calcium. La prise de masse correspond à la fixation du CO2 par la solution basique sous forme d'anion carbonate CO32-. 2Na+ + 2OH- + CO2 --> 2Na+ + CO32- + H2O Na+ est un ion qui n'intervient pas dans le processus( ion spectateur) Quantité de matière ( mol ): masse (g)/ masse molaire (g/mol) n(H2O) = 0,643/(2+16) = 0,0357 mol n(CO2) = 1,57/(12+2*16) = 0,0357 mol
|
||||
|
Synthèse du chlorure de vinyle en plusieurs étapes : - on fait réagir du dichlore sur l'éthylene en phase liquide a 50°C et sous une pression de 5.105 Pa ; - le composé X obtenu est ensuite chauffé vers 600°C sous une pression de 25.105 Pa, en présence de nickel et de chrome. On obtient du chlorure de vinyle et un gaz Y d'odeur piquante très soluble dans l'eau ; - pour identifier ce gaz, on procède à sa dissolution dans l'eau. La solution obtenue est jaune en présence de BBT et on obtient un précipité blanc noircissant à la lumière par ajout d'une solution aqueuse de nitrate d'argent.
corrigé éthylène + dichlore --> 1,2-dichlorométhane CH2=CH2+ Cl2 --> CH2Cl-CH2Cl solution aqueuse de nitrate d'argent. Ag+(aq) + NO3-(aq) : mise en évidence de l'ion chlorure Cl-. la couleur jaune du BBT met en évidence un milieu acide ( ion oxonium H3O+) Y est le chlorure d'hydrogène HCl(g) : HCl(g) + H2O = H3O+ + Cl-.( réaction acide base) CH2Cl-CH2Cl --> CH2=CHCl (chlorure de vinyle) + HCl nCH2=CHCl --> --[CH2--CHCl ] --n fois polychlorure de vinyle. |
||||
|
Trois solvants chlorés sont utilisés aujourd'hui : le chlorure de méthylène ou dichlorométhane CH2Cl2, , le trichloréthylène ClHC= CCl2 et le perchloréthylène, ou rétrachloroéthvlène, Cl2C= CCl2 . Le dichlorométhane peut être préparé directement par action du dichlore sur le méthane ; les deux autres peuvent l'être par action du dichlore sur l'éthylène H2C= CH2, avec élimination de chlorure d'hydrogène selon : Ces trois solvants sont ininflammables et n'affectent pas la couche d'ozone stratosphérique en raison de leur faible durée de vie. La France en produit environ 300 mille tonnes par an et en consomme à peu près le tiers.
corrigé 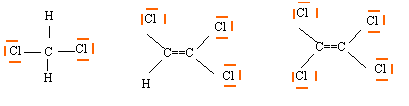
masse molaire C2Cl4 : M= 2*12+4*35,5 = 166 g/mol Qté de matière (mol) = masse (g) / masse molaire (g/mol) n(C2Cl4)= 2,5 108 / 166 = 1,506 106 mol n(C2H4)= 2 n(C2Cl4)=3,012 106 mol masse éthylène (g) = masse molaire (g/mol) * Qté de matière (mol) = 28*3,012 106 mol=8,43 107 g = 84,3 t. n(Cl2)= 7 n(C2Cl4)=1,054 107 mol volume de dichlore (L) = volume molaire (L/mol) * Qté de matière (mol)= 24*1,054 107 =2,53 108 L. n(C2HCl3)= n(C2Cl4)=1,506 106 mol masse C2HCl3 (g) = masse molaire (g/mol) * Qté de matière (mol) = 131,5* 1,506 106 =1,98 108 g = 198 t. n(HCl)= n(Cl2) = 1,054 107 mol volume acide chlorhydrique (L) = Qté de matière (mol) / concentration (mol/L)= 1,054 107 / 11 = 9,58 105 L = 958 m3.
|
||||
|
Pour chacune des équations ci-dessous, nommer les
réactifs et les produits, puis indiquer si la réaction associée est une
déshydratation, une substitution, une addition, une oxydation ou une
réduction…
CH3-CH=CH2 + H2O --> Z Pour cette dernière réaction, 2 isomères de Z sont envisageables, lequel obtient-on ?
butan-2-ol --> but-2-ène ( Z ou E) +eau
CH3-CH=CH2 + H2O --> CH3-CHOH-CH3 addition propène + eau --> propan-2-ol |
||||
|
Un volume V=25 mL de cyclohexanol C6H11-OH est agité avec une solution concentrée d'acide chlorydrique en excès. Après 30 minutes d'agitation, le mélange est introduit dans une ampoule à décanter. La phase aqueuse est éliminée, puis la phase organique est lavée avec une solution d'hydrogénocarbonate de sodium, Na+ + HCO3-; et enfin traitée par du sulfate de magnésium anhydre. La phase organique est filtrée, puis distillée ; la masse de distillat alors recueilli vaut m=25.7g. données : µ(cyclohexanol)=0.962g/mL ; µ(chlorocyclohexane)=1g/mL; µ(phase aqueuse)=1.10g/mL ; Teb(chlorocyclohexane)=142°C ; Teb(cyclohexanol)=161°C
corrigé H+ + HCO3- = CO2 (g) + H2O dégagement de dioxyde de carbone chlorocyclohexane + Ag+ donne un solide blanc AgCl. Lors de la distillation le chlorocyclohexane, composé organique le plus volatil , distille vers 142 °C On peut également déterminer sa masse volumique : 1 g/mL masse cyclohexanol(g) = volume (mL) * masse volumique ( g/mL) 25*0,962 = 24,05 g M(cyclohexanol)= 6*12+12+16 =100 g/mol n(cyclohexanol) = 0,24 mol C6H11-OH + H+ + Cl- = C6H11- Cl + H2O donc 0,24 mol chlorocyclohexane M (chlorocyclohexane)=6*12+11+35,5 = 118,5 g/mol masse théorique chlorocyclohexane (g): Qté de matièe (mol) * mase molaire g/mol) =118,5*0,24 = 28,4 g rendement : masse
réelle(g) / masse théorique (g)=25,7 / 28,4 = 0,9
|
||||
|
On réalise au laboratoire la déshydratation du 3,3-diméthylbutan-1-ol (CH3)3 C-CH2-CH2-OH. Après chauffage à reflux pendant trente minutes d'un mélange constitué de V = 30,0 mL de cet alcool et de 5 mL d'acide sulfurique concentré, le mélange est introduit dans une ampoule à décanter. La phase aqueuse est éliminé, puis la phase organique est lavée avec une solution d’hydrogénocarbonate de sodium Na+ + HC03- et, enfin, traitée par du sulfate de magnésium anhydre. Le mélange obtenu est filtré. On recueille une masse m’ = 11,6 g d’un alcène A.
Donnée : µ(3,3-diméthylbutan-1-ol) = 0,812 g.mL-1. corrigé H+ + HCO3- = CO2 (g) + H2O on élimine l'excès d'acide sulfate de magnésium : désséchant, élimine les traces d'eau (CH3)3C-CH=CH2 3,3-diméthylbut-1-ène mise en évidence de l'alcène : décolore l'eau de brome masse alcool (g) = masse volumique (g/mL) * volume (mL)=0.812*30 =24,36 g mase molaire alcool : M=12*6 + 14+16 = 102 g/mol n(alcool) = masse (g) / masse molaire (g/mol) =24,36/102 = 0,239 mol (CH3)3 C-CH2-CH2-OH = (CH3)3C-CH=CH2 +H2O donc d'après les coefficients de l'équation : 0,239 mol alcène M(alcène) = 6*12+12 = 84 g/mol masse alcène =masse molaire (g) * quantité de matière (mol) = 84*0,239 = 20,1 g rendement = masse réelle / masse théorique = 11,6/20,1 = 0,58 ( 58%) |
||||
|
On souhaite determiner la formule brute d'une espece chimique X. Un échantillon est brulé en presence d'un excés de dioxygène et de produits de combustion sont récupérés.On ne trouve que CO2 et H2O.
corrigé les hydrocarbures et les composés oxygénés conduisent par combustion au CO2 et à H2O : on ne peut pas donner le nom de la famille à laquelle appartient X. aldehyde : test positif à la liqueur de Fehling formule brute : CxHyO ; M= 12 x+y+16 % massique d'élément oxygène : 100-66,7-11,1 = 22,2 % 12x/66,7= y/ 11,1 = 16 / 22,2 = M/100 d'où M= 1600/22,2 = 72 g/mol et x=4 et y=8 CH3-CH2-CH2-CHO : butanal CH3-CH(CH3)
-CHO : 2-méthylpropanal
|
||||
|
|